
| A. | 原子半径的大小顺序:r(Z)>r(W)>r(Y)>r(X) | |
| B. | 元素Y的简单气态氢化物的热稳定性比W的弱 | |
| C. | 化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂 | |
| D. | 由X、Y、Z、W四种元素组成的两种化合物不能发生化学反应 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X是形成化合物很多的元素,且X常见化合价为+1和-1,则X为H元素;Y原子最外层电子数是次外层的3倍,则Y含有2个电子层,最外层含有6个电子,为O元素;Z与X处于同一主族,Z的原子序数对应O,则Z为Na元素;W的原子序数是Y的2倍,则W为S元素,据此结合元素周期律知识解答.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X是形成化合物很多的元素,且X常见化合价为+1和-1,则X为H元素;Y原子最外层电子数是次外层的3倍,则Y含有2个电子层,最外层含有6个电子,为O元素;Z与X处于同一主族,Z的原子序数对应O,则Z为Na元素;W的原子序数是Y的2倍,则W为S元素,
A.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则原子半径大小顺序为:r(Z)>r(W)>r(Y)>r(X),故A正确;
B.非金属性Y大于W,则元素Y的简单气态氢化物的热稳定性比W的强,故B错误;
C.化合物Na2O2与H2O反应时,化合价升高和降低的都过氧化钠中的-1价氧元素,则Na2O2既是氧化剂又是还原剂,故C正确;
D.X、Y、Z、W四种元素组成的两种化合物为硫酸氢钠和亚硫酸氢钠,亚硫酸氢钠与硫酸氢钠发生反应生成硫酸钠、二氧化硫和水,故D错误;
故选BD.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有非极性键 | B. | 分子晶体中的分子内不含有离子键 | ||
| C. | 原子晶体中可能含有非极性键 | D. | 分子晶体中的分子内一定有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
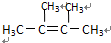 .
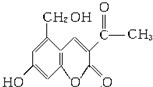
.
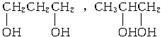
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+、Br-、SO42- | B. | Na+、K+、OH-、SiO32- | ||
| C. | Ca2+、K+、Br-、Cl- | D. | Li+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未洗涤烧杯和玻璃棒 | B. | 转移溶液前溶液未冷却至室温 | ||
| C. | 容量瓶未干燥 | D. | 定容时俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
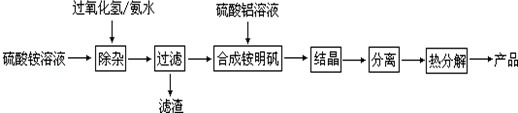
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积.该小组设计的简单实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积.该小组设计的简单实验装置如图所示:该实验的主要操作步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com