
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 常见气态氢化物的稳定性:X<Y<Z | |
| C. | 1molWM溶于足量水中完全反应,共转移2mol电子 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
分析 由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,X与Z可形成XZ2分子,X为+4价,Z为-2价,可推出X、Y、Z分别为C、N、O三种元素;Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,则M为H元素;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,推出W的质子数为$\frac{1}{2}$(6+7+8+1)=11,所以W为Na元素,以此解答该题.
解答 解:由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,X与Z可形成XZ2分子,X为+4价,Y为-2价,可推出X、Y、Z分别为C、N、O三种元素;Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,则M为H元素;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,推出W的质子数为$\frac{1}{2}$(6+7+8+1)=11,所以W为Na元素,
A.所有元素中H原子半径最小,同周期自左向右原子半径减小,同主族自上到下原子半径增大,故原子半径Na>C>N>O>H,即W>X>Y>Z>M,故A错误;
B.X、Y、Z分别为C、N、O三种元素,非金属性X<Y<Z,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.NaH与水发生反应:NaH+H2O=NaOH+H2↑,1molNaH溶于足量水中完全反应共转移1mol电子,故C错误;
D.由X、Y、Z、M四种元素形成的化合物可为氨基酸或碳酸铵、醋酸铵等物质,如为氨基酸,则只含有共价键,故D错误.
故选B.
点评 本题考查元素的结构与元素的性质,侧重于学生的分析能力的考查,为高考常见题型,题目难度中等,注意正确推断元素的种类为解答该题的关键,易错点为D.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时,50g 98%浓硫酸和50g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 标准状况下,活泼金属与稀硫酸反应转移2NA个电子时,可产生22.4L气体 | |
| C. | 6.4g SO2溶于水配成1L溶液,含有H2SO3的分子数为0.1NA | |
| D. | 1mol C3H6分子中碳碳共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷 | |
| D. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
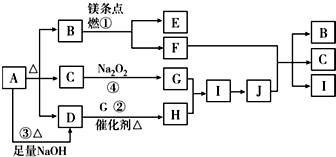
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
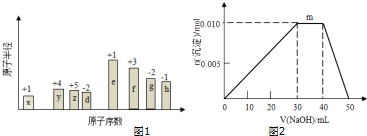
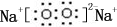 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022. ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在容器中充入2mol SO2(g)和2mol O2(g)充分反应,最终放出的热量为196kJ | |
| B. | 如果2molSO3(g)完全分解成SO2(g)和O2(g)时需要吸收196kJ的热量,若加入适当的催化剂后,分解所需要的热量会小于196kJ | |
| C. | 在接触法制硫酸中,通常不采用低温或者很大压强的方式来提高三氧化硫的产率 | |
| D. | 工业生产中,在吸收塔内用水吸收SO3,促进平衡的正向移动,提高了原料利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都能发生氧化反应 | |
| D. | 乙醇和乙酸之间能发生酯化反应,在浓硫酸的作用下乙醇和乙酸有一种能消耗完 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com