
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 A含有一个六元碳环且能与Na反应,则A中含有-OH或-COOH,有机物A完全燃烧后只生成二氧化碳和水,说明没有碳氢氧以外的元素,A的相对分子质量为100,A含有一个六碳环,6个碳原子式量为72,-COOH的式量为45,不符合,故分子含有1个-OH,式量为17,利用残余法可知,剩余基团或原子的总式量为100-72-17=11,故还有11个H原子,A的结构简式为 ,环上的取代物,除了-OH的邻、间、对位置外,羟基连接的碳也还有氢原子,可以取代.
,环上的取代物,除了-OH的邻、间、对位置外,羟基连接的碳也还有氢原子,可以取代.
解答 解:A含有一个六元碳环且能与Na反应,则A中含有-OH或-COOH,有机物A完全燃烧后只生成二氧化碳和水,说明没有碳氢氧以外的元素,A的相对分子质量为100,A含有一个六碳环,6个碳原子式量为72,-COOH的式量为45,不符合,故分子含有1个-OH,式量为17,利用残余法可知,剩余基团或原子的总式量为100-72-17=11,故还有11个H原子,A的结构简式为 ,环上的取代物,除了-OH的邻、间、对位置外,羟基连接的碳也还有氢原子,可以取代,共4种,故选D.
,环上的取代物,除了-OH的邻、间、对位置外,羟基连接的碳也还有氢原子,可以取代,共4种,故选D.
点评 本题考查同分异构体、有机物的推断等,注意残余法确定有机物的结构是解题的关键.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题
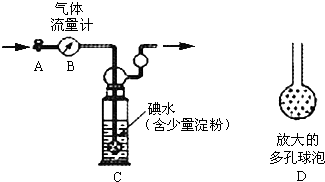 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质内部储存的能量--化学反应的热效应 | |
| B. | 分子间作用力的大小--分子稳定性的高低 | |
| C. | 原子核外电子排布--元素在周期表中的位置 | |
| D. | 有效碰撞几率的高低--化学反应速率的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质B的转化率增大 | B. | 平衡向正反应方向移动 | ||
| C. | 物质A的体积分数增大 | D. | a+b>m+n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
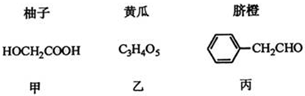
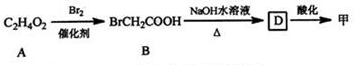
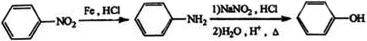
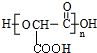 +(n-1)H2O.
+(n-1)H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮族元素的单质及其化合物在农药、化肥等方面有重要应用.我们可以利用物质结构与性质的相关知识去认识和利用它们,
氮族元素的单质及其化合物在农药、化肥等方面有重要应用.我们可以利用物质结构与性质的相关知识去认识和利用它们,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
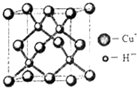 自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其 中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用.| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
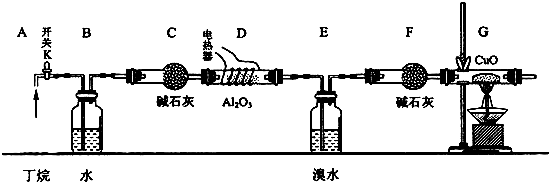

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com