
| A. | 干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同 | |
| B. | 白磷(P4)分子是正四面体结构,故分子中的键角为1090281 | |
| C. | CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
分析 A.干冰为分子晶体,二氧化硅为原子晶体;
B.白磷是正四面体分子,键角是60°;
C.氯化铯晶体中阴阳离子的配位数都是8;
D、离子晶体中离子键越强晶格能越大,电荷越多、离子半径越小,离子键越强.
解答 解:A.干冰为分子晶体,熔化时克服分子间作用力,二氧化硅为原子晶体,熔化时克服共价键,故A正确;
B.白磷是正四面体分子,键角是60°,故B错误;
C.氯化铯晶体中阴阳离子的配位数都是8,所以氯化铯晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等,故C正确;
D、离子半径F-<Cl-<Br-<I-,故离子键强度NaF>NaCl>NaBr>NaI,故晶格能NaF>NaCl>NaBr>NaI,故D正确;
故选B.
点评 本题考查不同类型的晶体及性质,明确常见物质的晶体类型是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有13个质子的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ⑥⑧ | C. | ②⑤ | D. | ③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
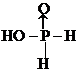 .H3PO2是一元(填“一”、“二”或“三”)酸.
.H3PO2是一元(填“一”、“二”或“三”)酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.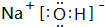 ,气态氢化物最稳定的物质是HF,并用电子式表示其形成过程
,气态氢化物最稳定的物质是HF,并用电子式表示其形成过程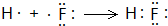 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
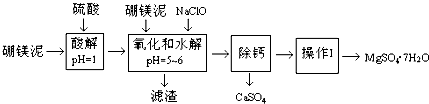
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
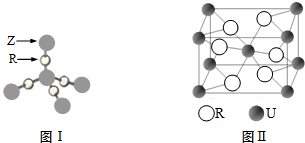
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com