
 下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题:
下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题: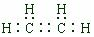 .
. ,A是一种常用的还原剂.向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式4AgBr+N2H4=4Ag+N2↑+4HBr.b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为1:2.
,A是一种常用的还原剂.向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式4AgBr+N2H4=4Ag+N2↑+4HBr.b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为1:2.分析 部分短周期元素,由表中化合价可知,a的化合价为-4价,故a为C元素,b的化合价为-3价,原子序数大于C元素,故b为N元素,c为-2价,且无正价,为O元素,d的化合价为+1价是钠元素,e的化合价是+6、-2价,故e为S元素,f的最高正价为+7价,应为Cl元素,结合对应单质、化合物的性质以及题目要求解答该题.
解答 解:(1)16号硫元素,三个电子层,最外层6个电子,在周期表中的位置为:第三周期第ⅥA族,碳的某种氢化物的相对分子质量是28,分子式为:C2H2,电子式为: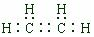 ,故答案为:第三周期第ⅥA族;
,故答案为:第三周期第ⅥA族;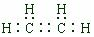 ;
;
(2)电子层数越多半径越大,电子层相同,核电荷数越多半径越小,所以离子半径由大到小的顺序为S2->O2->Na+;强制弱的原理,可用氯气与硫化氢反应,生成单质硫,反应的化学方程式为:Cl2+H2S=2HCl+S↓,故答案为:S2->O2->Na+;Cl2+H2S=2HCl+S↓;
(3)氮与氢元素按原子数2和4构成分子式为:N2H4,A的结构式为 ,可观察到固体逐渐变黑生成单质银,并有气泡产生是氮气,反应的化学方程式为:4AgBr+N2H4=4Ag+N2↑+4HBr,N与O按原子数2和4构成分子四氧化二氮,所肼反应生成氮气,N2H4中的氮-2价变成0,四氧化二氮中的氮+4价变成0价,所以氧化剂与还原剂的物质的量之比为1:2,故答案为:
,可观察到固体逐渐变黑生成单质银,并有气泡产生是氮气,反应的化学方程式为:4AgBr+N2H4=4Ag+N2↑+4HBr,N与O按原子数2和4构成分子四氧化二氮,所肼反应生成氮气,N2H4中的氮-2价变成0,四氧化二氮中的氮+4价变成0价,所以氧化剂与还原剂的物质的量之比为1:2,故答案为: ; 4AgBr+N2H4=4Ag+N2↑+4HBr;1:2;
; 4AgBr+N2H4=4Ag+N2↑+4HBr;1:2;
(4)氧、钠两种元素形成的阴、阳离子数目比为1:2的化合物有氧化钠和过氧化钠,故答案为:氧化钠和过氧化钠;
(5)溶液中的氢离子既包括硝酸电离的又包括硫酸电离的,所以n(H+)=0.3mol/L×0.1L+0.15mol/L×0.1L×2=0.06mol,
n(NO3-)n=0.3mol/L×0.1L=0.03mol,
2.56g铜的物质的量为$\frac{2.56g}{64g/mol}$=0.04mol;
硝酸和铜反应的离子方程式如下:3Cu+8H++2NO3-=3Cu2++2NO+3H2O
3Cu~~~~~8H+~~~~2NO3-~~~~3Cu2+.
3 8 2 3
0.04mol 0.11mol 0.027mol
所以氢离子的物质的量不足,根据氢离子的物质的量计算,由离子方程式可知0.06mol氢离子反应,消耗铜的物质的量为0.06mol×$\frac{3}{8}$=0.0225mol,所以生成的铜离子的物质的量为0.0225mol,所以溶液中c(Cu2+)=$\frac{0.0225mol}{0.1L}$=0.225mol•L-1;故选:b.
点评 本题考查结构性质与位置关系、元素周期律等,难度不大,关键是根据化合价结合原子序数进行推断,首先审题中要抓住“短周期元素”几个字.


科目:高中化学 来源: 题型:解答题
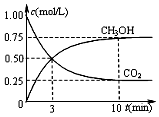 燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇.
燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②⑤⑧ | C. | ③⑧⑥ | D. | ⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 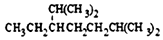 2,6-二甲基-5-乙基庚烷 | B. | 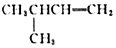 3-甲基-1-丁烯 | ||
| C. | 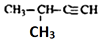 2-甲基-3-丁烯 | D. | 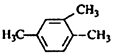 1,3,4-三甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
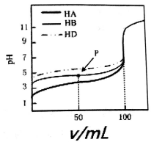
| A. | HA、HB和HD均为弱酸 | |
| B. | P点时,c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 三种酸溶液分别被NaOH溶液恰好完全中和后互混:c(HA)+c(HB)+c(HD)═c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
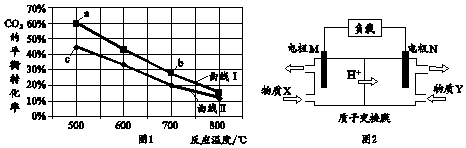
| A. | 图1中b点对应的平衡常数K值大于c点 | |
| B. | 图1中a点对应的H2的转化率等于30% | |
| C. | 图2中电极M上发生还原反应 | |
| D. | 图2中电极N的反应式:H2O2+2e-+6H+=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 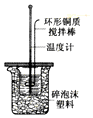 中和反应反应热的测得 | B. | 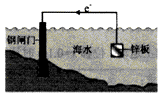 牺牲阳极的阴极保护法 | ||
| C. | 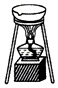 灼烧胆矾晶体测结晶水含量 | D. | 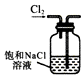 除去Cl2中混有的HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.lmolC2H6O分子中含C-H键数目为0.5NA | |
| B. | 1L1mol•L-1的NH4Cl溶液中含有NH4+数目为0.1NA | |
| C. | 8.4gNaHCO3和MgCO3混合物中含有阴离子数目为0.1NA | |
| D. | 标准状况下,2.24LCl2与过量NaOH溶液反应转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com