
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。请回答下列问题:
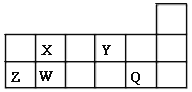
(1)W在周期表中的位置是___________,Y、Z的离子半径由大到小的顺序为___________ (用元素符号表示);由X与氢元素组成四原子化合物的电子式为__________。
(2)下列说法正确的是____________。
a.XY2和WY2都能溶于水生成对应的酸
b.Q的含氧酸的酸性比X的含氧酸的酸性强
c.X的最简单气态氢化物的稳定性大于W的最简单气态氢化物的稳定性
d.由NaOH溶液分别滴入MgQ2、ZQ3溶液中的反应现象可比较Mg和Z金属性的强弱
(3)自来水厂常用QY2对饮用水进行消毒,处理后的水中要求QY2的浓度在0.10~0.80 mg·L-1之间。碘量法可以检测水中QY2的浓度,步骤如下:
操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,再用NaOH溶液调至中性,并加入淀粉溶液,溶液变蓝。
操作Ⅱ:再加入一定量的Na2S2O3溶液。(已知:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)
+2I-)
操作Ⅲ:然后再加硫酸调节水样pH至1~3。
操作时,不同pH环境中Q元素粒子种类及化合价如图所示:
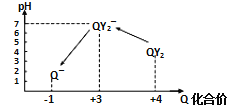
①操作Ⅰ中反应的离子方程式是_________________________。
②确定操作Ⅱ完全反应的现象是_________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是______________________。
④若水样的体积为1.0 L,在操作Ⅱ中消耗了1.0×10-3mol·L-1的Na2S2O3溶液10 mL,则水样中QY2的浓度是_______________mg·L-1(精确到0.01)。
【答案】(1)第三周期IVA族;O2->Al3+;![]() ;
;
(2)cd;
(3)①2ClO2+2I-=2ClO2-+I2;②蓝色消失,半分钟内不变色;
③ClO2-+4I-+4H+=Cl-+2I2+2H2O;④0.68。
【解析】试题分析:根据短周期元素X、Y、Z、W、Q在元素周期表中的相对位置可知,X为C元素、Y为O元素、Z为Al元素、W为Si元素、Q为Cl元素。
(1)W为Si元素,在周期表中的位置为第三周期IVA族,Y为O元素、Z为Al元素,两元素的离子具有相同的电子层结构,核电荷数越小,离子半径越大,离子半径由大到小的顺序为O2->Al3+;由C与氢元素组成四原子化合物为乙炔,电子式为![]() ,故答案为:第三周期IVA族;O2->Al3+;
,故答案为:第三周期IVA族;O2->Al3+;![]() ;
;
(2)a.SiO2不溶于水,错误;b.次氯酸的酸性比碳酸弱,错误;c.元素的非金属性越强,气态氢化物越稳定性,因此甲烷的稳定性大于硅烷,正确;d.氢氧化铝能够被氢氧化钠溶液,说明氢氧化铝具有两性,因此氢氧化镁的碱性强于氢氧化铝,能够说明Mg的金属性比铝强,正确;故选cd;
(3)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2+2I-=2ClO2-+I2,故答案为:2ClO2+2I-=2ClO2-+I2;
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-,故蓝色会消失,故答案为:蓝色消失,半分钟内不变色
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,离子方程式为:ClO2-+4I-+4H+=Cl-+2I2+2H2O,故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④S2O32-~ I-~ ClO2
1 1 1
1.0×10-3mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mgmol-1=0.675mg,
由于水样为 1L,所以 ClO2的浓度为![]() ="0.675" mgL-1=0.68mgL-1,故答案为:0.68。
="0.675" mgL-1=0.68mgL-1,故答案为:0.68。


科目:高中化学 来源: 题型:
【题目】下列各物质中的少量杂质,可用括号内的试剂和方法除去的是
A.苯中溶有苯酚(浓溴水,过滤) B.甲烷中含有乙烯(溴水,洗气)
C.溴苯中溶有溴(苯,分液) D.乙醇中含有水(金属钠,蒸馏)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.浓硫酸具有强氧化性,稀硫酸无氧化性
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸在常温下能够使铁、铝形成氧化膜而钝化
D.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯酚的叙述中,正确的是
A.呈弱酸性,使石蕊试液显浅红色 B.分子中的13个原子有可能处于同一平面
C.可以和NaHCO3溶液反应产生气体 D.能与FeCl3溶液反应生成紫色沉淀a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A.CO(g)+![]() O2(g)==CO2(g);△H=-283.0kJ/mol
O2(g)==CO2(g);△H=-283.0kJ/mol
B.C(s)+![]() O2(g)==CO(g);△H=-110.5kJ/mol
O2(g)==CO(g);△H=-110.5kJ/mol
C.H2(g)+![]() O2(g)==H2O(g);△H=-241.8kJ/mol
O2(g)==H2O(g);△H=-241.8kJ/mol
D.2C8H18(l)+25O2(g)==16CO2(g)+18H2O(l);△H=-11036kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500oC下,在2L体积固定的密闭容器中发生反应:2A(g)![]() 2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
(1)计算500oC时该反应的化学平衡常数?
(2)平衡时A的转化率是多少?
(3)设温度不变,反应前容器内压强为p0,则反应达平衡时,容器内压强是多少?(用p0表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳被广泛应用于冶金工业和电子工业。
(1)己知CO的燃烧热为283kJ/mol,请写出体现CO燃烧热的热化学方程式___________。
(2)高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s)△H=akJ/mol
CO(g)+Fe2O3(s)= CO2(g)+2Fe3O4(s)△H=bkJ/mol
请写出CO直接将Fe2O3还原为Fe的热化学方程式:____________(用含a,b的代数式表示△H的数值)。
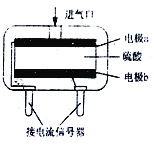
(3)使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如右图所示。这种传感器利用燃料电池原理,则该电池的负极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA
B. 将100 mL 0.1 mol·L﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
C. CO2通过Na2O2使其增重a g时,反应中转移的电子数为![]() NA
NA
D. 100 g质量分数为9.8%的H2SO4水溶液中含氧原子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成尿素的第一步反应在高温、高压、超临界态的二氧化碳与氨反应生成甲胺,在2 L的密闭容器中发生反应:CO2 (g) + 2NH3 (g)![]() NH4COONH2 (g) ΔH=" -117.2" KJ/mol 。下列措施能提高NH3转化率的是( )
NH4COONH2 (g) ΔH=" -117.2" KJ/mol 。下列措施能提高NH3转化率的是( )
A. 升高温度 B. 通入过量的CO2
C. 通入过量的NH3 D. 使用高效的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com