
【题目】己知A、B是生活中常見的有机物, E的产量是石油化工发展水平的标志.根据下面转化关系回答下列问题:
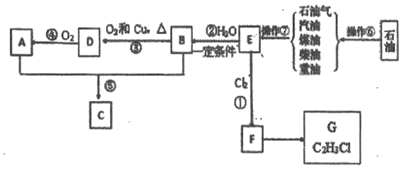
(1)在①~⑤中原子利用率为100%的反应是_____(填序号)。
(2)操作⑥、操作⑦的名称分別为_____、______。
(3)写出反应③的化学方程式________。
(4)写出反应⑤的化学方程式_________。
(5)G可以发生聚合反应生产塑料,其化学方程式为_______。
【答案】 ①②④ 分馏 裂解 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+CH3CH2OH
2CH3CHO+2H2O CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O 
【解析】本题考查的是有机物的推断,要根据反应条件和物质的结构进行分析,是常考题型。
E的产量是石油化工发展水平的标志,说明其为乙烯,根据反应条件分析,B为乙烯和水的反应生成的,为乙醇,D为乙醇催化氧化得到的乙醛,A为乙醛氧化生成的乙酸,C为乙醇和乙酸反应生成的乙酸乙醇。F为乙烯和氯气反应生成的1、2-二氯乙烷,G为1、2-二氯乙烷发生消去反应生成氯乙烯。(1)在①~⑤中,加成反应中原子利用率为100%,且醛的氧化反应原子利用率也为100%,所以答案为:①②④;(2) 操作⑥为石油分馏得到汽油煤油等产物,操作⑦是将分馏得到的汽油等物质裂解得到乙烯。(3) 反应③为乙醇的催化氧化,方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;(5)反应⑤为乙酸和乙醇的酯化反应,方程式为:CH3COOH+CH3CH2OH
2CH3CHO+2H2O;(5)反应⑤为乙酸和乙醇的酯化反应,方程式为:CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O;(6)氯乙烯可以发生加聚反应生成聚氯乙烯,方程式为:
CH3COOC2H5+H2O;(6)氯乙烯可以发生加聚反应生成聚氯乙烯,方程式为: 。
。


科目:高中化学 来源: 题型:
【题目】如图中的曲线是表示其他条件一定时,2NO(g)+O2(g) ![]() 2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )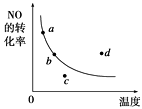
A.a点
B.b点
C.c点
D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,磁性材料的研究备受国际磁学界的关注。Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛。回答下列问题:
(1)水热法制备Fe3O=纳米颗粒的总反应为3Fe2++2S2O32-+O2+4OHˉ=Fe3O4+S4O62-+2H2O,下列说法正确的是_________(填字母)
A.S2O32-是氧化剂
B.被氧化的Fe2+和未被氧化的Fe2+个数之比为1:2
C.每生成1 mol Fe 3O4,则转移电子数为2mol
D.该反应中氧化剂与还原剂的物质的量之比为1:4
(2)已知:H2O(1)=H2(g)+1/2O2(g) △H1=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下:过程I的热化学方程式为2Fe3O4(s) ![]() 6FeO(s)+O2(g) △H2=+313.2kJ·mol-1,则过程II的热化学方程式为____________。
6FeO(s)+O2(g) △H2=+313.2kJ·mol-1,则过程II的热化学方程式为____________。

(3)化学共沉淀法是制备Fe3O4颗粒最常用的方法之一,方法是将FeSO4和FeCl3溶液以1:2投料比混合,再加入NaOH溶液,即可产生Fe3O4颗粒,则该反应的离子方程式为______________________,由下表数据可知,Fe2+和Fe3+的最佳投料比为1:1.85,原因可能是_____________________。
表 不同投料比得到Fe3O4的结果

(4)磁铁矿(Fe3O4)是工业上冶炼铁的原料之一,发生的主要反应为Fe3O4(s)+4CO![]() 3Fe(s)+4CO2,该反应的△H<0,T℃时,在1L恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
3Fe(s)+4CO2,该反应的△H<0,T℃时,在1L恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
①CO的平衡转化率是______________,T℃时,该反应的平衡常数K=__________。
②欲提高该反应中CO的平衡转化率,可采取的措施是_____________(任写一个即可)。
③其他条件不变时,该反应在不同温度下,CO2含量随时间的变化![]() (CO2)~t曲线如图所示,温度T1、T2、T3由大到小的关系是___________,判断依据是____________。
(CO2)~t曲线如图所示,温度T1、T2、T3由大到小的关系是___________,判断依据是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂是密度最小的活泼金属,其单质及其化合物如:LiAlH4、Li2CO3、 LiPF6等有广泛的用途。工业上以锂辉石(主要成分为LiAlSi2O6,还含有硫酸钙、硫酸镁和铁的氧化物)为原料,制备Li2CO3的的工艺流程如下:
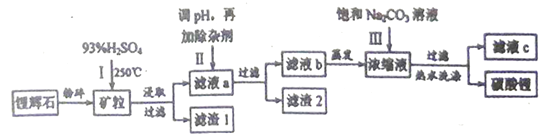
已知①LiAlSi2O6和H2SO4会生成SiO2
②
Fe3+ | A13+ | Fe2+ | Mg2+ | |
氢氧化物完全沉淀pH | 3.2 | 4.7 | 9.0 | 11.1 |
③某些物质的溶解度(S) 如下表
t/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
请回答下列问题:
(1)LiAlSi2O6改写成氧化物的形式是___________________。
己知表中40℃Li2CO3溶解度(饱和溶液的密度为ag/cm3),则Li2CO3的溶度积(Ksp) 为________,(用含有a的代数式表示)
(2)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子 方程式为____________________。
(3)己知滤渣2 的主要成分有Mg(OH)2 。向滤液a中加入石灰乳的作用是(运用化学平衡原理简述)___________________。用热水洗涤Li2CO3固体目的是___________________。
Ⅱ.锂单质制备及其化合物的性质
1)用碳酸锂和盐酸反应得到氯化锂溶液,写出如何从氯化锂溶液得到无水氯化锂固体的实验方法__________________。
(2) 已知2Li+H2![]() 2LiH,LiH固体密度为0 8g/cm3,用锂吸收22.4L (标准状况) H2, 生成的LiH体积与 被吸收 的 H2 体积 比 为________________。
2LiH,LiH固体密度为0 8g/cm3,用锂吸收22.4L (标准状况) H2, 生成的LiH体积与 被吸收 的 H2 体积 比 为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,表中的①~⑨中元素,用元素符号或化学式填空回答:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为。
(2)地壳中含量最多的金属元素是。
(3)②与④形成的化合物的电子式。
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 , 碱性最强的是 , 呈两性的氢氧化物是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象不能实验预期的目的是( )
A.用食醋,石灰水来验证蛋壳的成分是碳酸盐
B.用银氨溶液鉴别乙醇和乙醛
C.用酸性高锰酸钾验证苯中是否含有碳碳双键
D.用溴水鉴别乙烯和乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.钠的密度小,可用于制高压钠灯B.Al2O3熔点高,可用于制耐高温材料
C.MnO2不溶于水,可作H2O2分解的催化剂D.活性炭具有还原性,可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学体检的血液化验单中,葡萄糖为0.0059 molL1。表示该体检指标的物理量是
A. 溶解度(S)B. 物质的量浓度(c)
C. 质量分数(ω)D. 摩尔质量(M)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,半径最大的是
A. ls22s22p63s23p2 B. 1s22s22p3 C. 1s22s2sp2 D. 1s22s22p63s23p4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com