
分析 (1)二氧化氮和水反应生成硝酸和一氧化氮;
(2)NO被CO还原,可生成氮气和二氧化碳;
(3)NO、NO2的混合气体3L,用同温同压下3.5LNH3使其恰好完全转化为N2,体积比等于物质的量比,可设混合气体3mol,NO、NO2分别为xmol、ymol,与氨气反应时遵循电子守恒,以此来解答;
(4)由NO2+NO+2NaOH═2NaNO2+H2O、2NO2+2NaOH═NaNO2+NaNO3+H2O可知,标准状况下aL NO2和bL NO,若用500mLNaOH溶液能恰好吸收完全,则n(N)=n(NaOH),结合c=$\frac{n}{V}$计算;
(5)假定为3molNO2,通过饱和碳酸氢钠溶液,首先发生3NO2+H2O=2HNO3+NO,生成1molNO、2molHNO3,再发生反应:HNO3+NaHCO3=NaNO3+CO2↑+H2O,生成2molCO2,从饱和碳酸氢钠溶液出来的气体为1molNO、2molCO2及水蒸气,再通过浓硫酸干燥,出来的气体为1molNO、2molCO2,气体通过过氧化钠,发生反应2CO2+2Na2O2═2Na2CO3+O2、2NO+O2=2NO2,从过氧化钠出来的气体最终为0.5molO2、1molNO2,最后用排水法收集,发生反应4NO2+O2+2H2O=4HNO3,据此计算解答.
解答 解:(1)二氧化氮和水反应生成硝酸和一氧化氮,反应方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(2)由题意可知,NO被CO还原,可生成氮气和二氧化碳,反应的方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(3)NO、NO2的混合气体3L,用同温同压下3.5LNH3使其恰好完全转化为N2,体积比等于物质的量比,可设混合气体3mol,氨气3.5mol,NO、NO2分别为xmol、ymol,
$\left\{\begin{array}{l}{x+y=3\\;}\\{2x+4y=3.5×3}\end{array}\right.$,解得x=0.75mol,y=2.25mol,
则混合气体中NO2、NO的物质的量之比为2.25mol:0.75mol=3:1,故答案为:3:1;
(4)由NO2+NO+2NaOH═2NaNO2+H2O、2NO2+2NaOH═NaNO2+NaNO3+H2O可知,标准状况下aL NO2和bL NO,若用500mLNaOH溶液能恰好吸收完全,则n(N)=n(NaOH),结合c=$\frac{n}{V}$=$\frac{\frac{a+b}{22.4}}{0.5}$=$\frac{a+b}{11.2}$,故答案为:$\frac{a+b}{11.2}$;
(5)假定为3molNO2,通过饱和碳酸氢钠溶液,首先发生3NO2+H2O=2HNO3+NO,生成1molNO、2molHNO3,再发生反应:HNO3+NaHCO3=NaNO3+CO2↑+H2O,生成2molCO2,从饱和碳酸氢钠溶液出来的气体为1molNO、2molCO2及水蒸气,再通过浓硫酸干燥,出来的气体为1molNO、2molCO2,气体通过过氧化钠,发生反应2CO2+2Na2O2═2Na2CO3+O2,生成1molO2,再发生反应2NO+O2=2NO2,1molNO消耗0.5molO2,生成1molNO2,故从过氧化钠出来的气体最终为0.5molO2、1molNO2,最后用排水法收集,发生反应4NO2+O2+2H2O=4HNO3,1molNO2消耗O2为1mol×$\frac{1}{4}$=0.25mol,故最终剩余的氧气为0.5mol-0.25mol=0.25mol,体积之比等于物质的量之比,故最终收集到的气体是0.25体积的O2,所以9mLNO2时集气瓶中的气体体积为0.25×$\frac{9}{3}$=0.75,故答案为:0.75.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
 )是一种治疗心脏病的药物,可由甲基丙烯、丙烯和
)是一种治疗心脏病的药物,可由甲基丙烯、丙烯和 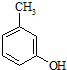 为原料制取.
为原料制取.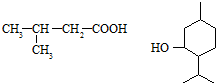 .
.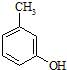 的名称3-甲基苯酚,其属于芳香族化合物的同分异构有4种(不含
的名称3-甲基苯酚,其属于芳香族化合物的同分异构有4种(不含 ).
). +CH3-CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3-CH=CH2$\stackrel{AlCl_{3}}{→}$ 反应类型属于加成反应.有机反应中通常副反应较多,实际生产中发现生成
反应类型属于加成反应.有机反应中通常副反应较多,实际生产中发现生成 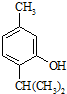 的量远大于生成
的量远大于生成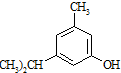 的量,试分析其原因:羟基使得苯环的邻对位氢原子易于取代.
的量,试分析其原因:羟基使得苯环的邻对位氢原子易于取代.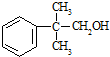 的合成线路:(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物 )
的合成线路:(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物 ) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
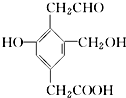 某有机物X的结构简式如图所示.若1mol X分别与H2、Na、NaOH、NaHCO3恰好完全反应,则消耗H2、Na、NaOH、NaHCO3的物质的量之比为( )
某有机物X的结构简式如图所示.若1mol X分别与H2、Na、NaOH、NaHCO3恰好完全反应,则消耗H2、Na、NaOH、NaHCO3的物质的量之比为( )| A. | 4:3:2:1 | B. | 3:3:2:1 | C. | 4:3:2:2 | D. | 3:3:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol•L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol•L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐的电离平衡被破坏 | B. | 水的电离程度一定会增大 | ||
| C. | 溶液的pH一定会增大 | D. | c(H+)与c(OH-)的乘积一定会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
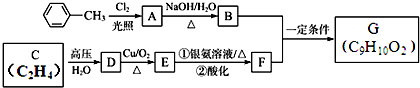
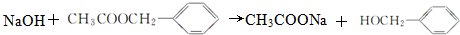 .
. 、
、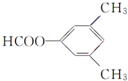 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| B. | Na的金属性比Cu强,故可用Na与CuSO4溶液反应制取Cu | |
| C. | 不能用带玻璃塞的玻璃瓶盛放碱液 | |
| D. | 玻璃、水泥、陶瓷、水晶都是重要的硅酸盐材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com