
| A. | 只含非极性键的纯净物一定是单质 | B. | 只含极性键的纯净物一定是化合物 | ||
| C. | 离子化合物中一定有离子键 | D. | 纯净物中一定存在化学键 |
分析 A.离子化合物、共价化合物中可能含非极性键,但只含非极性键一定为单质;
B.含极性键一定存在不同元素;
C.含离子键的一定为离子化合物;
D.稀有气体的单质中不含化学键.
解答 解:A.只含非极性键,则一定只有一种元素组成,则纯净物为单质,故A正确;
B.含极性键一定存在不同元素,则一定为化合物,故B正确;
C.含离子键的一定为离子化合物,则离子化合物中一定有离子键,故C正确;
D.稀有气体的单质中不含化学键,则纯净物中不一定存在化学键,故D错误;
故选D.
点评 本题考查化学键,为高频考点,把握化学键的判断、物质的组成为解答的关键,侧重分析与应用能力的考查,注意物质的组成及类别判断,题目难度不大.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | T1(OH)3是两性氢氧化物 | B. | 铊与酸反应比铝更剧烈 | ||
| C. | Tl3+的氧化能力比Al3+弱 | D. | 铊是易导电的银白色金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.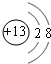 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.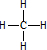 ,R、T的氢化物的稳定强的HCl(填化学式)
,R、T的氢化物的稳定强的HCl(填化学式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
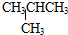
 和
和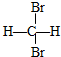
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种分子的中心原子的杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 | |
| B. | NH3分子中氮原子形成3个杂化轨道,CH4分子中碳原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 | |
| D. | 氨气分子是四原子化合物,甲烷为五原子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2分子中6个原子都共面,而CH3CH═CH2分子中最多有7个原子共面 | |
| B. | 苯是平面正六边形分子,其中存在单双键交替的结构 | |
| C. | 正戊烷分子中的碳原子之间以碳碳单键结合成直线状 | |
| D. | CH3Cl没有同分异构体说明CH4是正四面体结构,而非平面正方形 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数≥4的金属元素有6种,元素符号分别是Ge Sn Pb Te Bi Po | |
| B. | 过渡元素全部属于副族元素,全部都是金属元素,它们位于周期表第3纵行至第12纵行 | |
| C. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为1或2 | |
| D. | 在元素周期表中位于ⅡB族左右两列元素分别是ⅠB和ⅢB |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com