
【题目】最简式相同,但既不是同系物,又不是同分异构体的是
A.辛烯和3—甲基一1一丁稀
B.苯和乙烯
C.1 一氯丙烷和2一氯丙烷
D.甲基环己烷和乙烯
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】CuCl2广泛应用于工业生产,溶于水形成绿色溶液。CuCl晶体呈白色,露置于潮湿空气中易被氧化,实验室用图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。
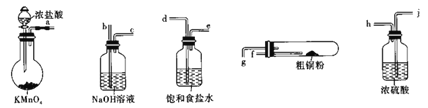
(1)完成上述实验,气流方向连接各仪器接口的顺序是________a→______、____→______、_____→______、 _________→________;反应时,盛粗铜粉的试管中现象是_______________。
(2)实验完毕,取试管中的固体有盐酸溶解后,欲提纯氯化铜,请简述实验方案:_________________。(室温,Fe(OH))3 沉淀完全的pH为3.2)
(3)向制得的氯化铜溶液中通入SO2,加热一段时间既可制得CuCl,写出该反应的离子方式:_______。
(4)已知:ⅰ.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O
ⅱ.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
某同学利用如图所示装置,测定某混合气体中H2、CO、SO2和O2的百分组成

①D瓶测定__________;F洗气瓶中盛放的试剂是__________________。
②E瓶中发生反应的离子方程式为____________________。
③为了准确读取G中量气管的数据,读数时除了视线与凹液面最低处相平以外,还要注意__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别方法不可行的是( )
A.用水鉴别乙醇、甲苯和溴苯
B.用燃烧法鉴别乙醇、苯和四氯化碳
C.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
D.用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O ![]() H+ + OH- ΔH>0 ,下列叙述正确的是( )
H+ + OH- ΔH>0 ,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量冰醋酸,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g) ![]() 3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
A.4molA+2molB B.3molC+1molB+1molD+1molA
C.2molA+1molB+1molD D.1molA+0.5molB + 1.5molC+0.5molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题已经成为世界上越来越重要的议题,其中大气污染主要有硫的氧化物和氮的氧化物,工业生产是其原因之一,同时工业上通常也用下列方法来治理污染。
(1)烟气中含有SO2等大量有害的物质,烟气除硫的方法有多种,其中石灰石法烟气除硫工艺的主要反应如下:
Ⅰ.CaCO3(s)= CO2(g)+CaO(s) △H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)=CaSO3(s) △H=﹣402kJ/mol
Ⅲ.2CaSO3(s)+O2(g)+4H2O(l)=2[CaSO42H2O](s) △H=﹣234.2kJ/mol
试写出由石灰石、二氧化硫、氧气和水反应生成生石膏的热化学方程式 .
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气体3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)氨催化氧化是硝酸工业的基础,反应原理为:4NH3(g)+5O2(g)4NO(g)+6H2O(g)实际生产中,还会发生此反应:4NH3+3O2N2+6H2O,在1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中,有关温度与各物质的量关系如图1所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x= 。
②NH3生成N2的反应属于 (填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是 。
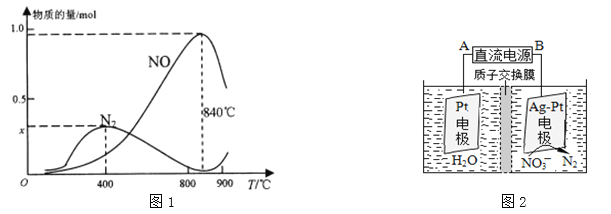
(4)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO![]() 的原理如图2所示,阴极反应式为 。假设降解前两极溶液质量相等,当电路中有2mol电子通过时,此时两极溶液质量的差值为 g。
的原理如图2所示,阴极反应式为 。假设降解前两极溶液质量相等,当电路中有2mol电子通过时,此时两极溶液质量的差值为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的。
(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为_____________________________________。
(2)脱硫:①某种脱硫工艺将废气处理后可获得硫酸铵和硝酸铵,物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,前者的c(NH4+)与后者的c(NH4+)的关系是__________。
A.大于2倍 B.等于2倍 C.介于2倍与2倍之间 D.小于1倍
②25℃时pH均为4的硝酸铵溶液和稀硝酸中由水电离出的氢离子浓度分别为c1、c2 ,则c1与c2的比值等于_______。
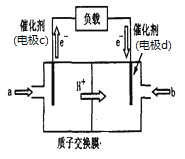
(2)脱碳:废气中的CO2转化为甲醇(CH3OH)可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液.电极c上发生的电极反应式为____,当电池中有1mole-发生转移时左右两侧溶液的质量之差为___g (假设反应物a、b耗尽,忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式中化学式的右边要注明物质状态,主要是因为
A. 物质呈现的状态与反应热有关
B. 可以具体说明反应进行的情况
C. 物质呈现的状态与生成什么物质有关
D. 说明反应条件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是
A.放电时正极附近溶液的碱性增强
B.放电时每转移3mol电子,正极有1molK2FeO4被还原
C.充电时锌极与外电源负极相连
D.充电时阳极反应为Fe(OH)3-3e-+H2OFeO42-+5H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com