
【题目】能表示H2(g)+ I2(g)![]() 2HI(g)已经达到平衡状态的标志是( )
2HI(g)已经达到平衡状态的标志是( )
①c(H2)=c(I2)=c(HI)时
②c(H2):c(I2):c(HI)=1:1:2时
③c(H2)、c(I2)、c(HI)不再随时间而改变
④单位时间内生成nmolH2的同时生成2nmolHI
⑤单位时间内生成nmolH2的同时生成nmolI2
⑥反应速v(H2)=v(I2)=1/2v(HI)
⑦一个H-H键断裂的同时有两个H-I键断裂
⑧温度和体积一定时,容器内压强不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
条件一定,混合气体的平均相对分子质量不再变化
A.③④⑦⑨⑩B.③④⑦⑨C.②③④⑦⑨D.②③④⑥⑦⑨
【答案】B
【解析】
根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
①平衡时c(H2)、c(I2)、c(HI)三者可能相等,也可能不等,与各物质的初始浓度及转化率有关,故错误;
②平衡时浓度c(H2):c(I2):c(HI)可能为1:1:2,也可能不等,与各物质的初始浓度及转化率有关,故错误;
③c(H2)、c(I2)、c(HI)不再随时间而改变,说明正逆反应相等,故正确;
④单位时间内生成nmolH2,等效于消耗2nmolHI,同时生成2nmolHI,故正确;
⑤单位时间内生成n mol H2的同时生成n mol I2,都体现逆反应方向,故错误;
⑥只要反应发生,就符合反应速率v(H2)=v(I2)=1/2v(HI),故错误;
⑦一个H-H键断裂等效于两个H-I键形成同时有两个H-I键断裂,正逆反应速率相等,故正确;
⑧温度和体积一定时,容器内压强一直不再变化,故错误;
⑨温度和体积一定时,混合气体的颜色不再变化,说明碘蒸气的浓度不变,反应达平衡状态,故正确;
⑩温度和压强一定时,混合气体的密度一直不再变化,故错误;
条件一定,混合气体的平均相对分子质量一直不再变化,故错误;
故选:B.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍; W、X、Y三种简单离子的核外电子排布相同。下列说法不正确的是:
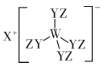
A.原子半径:W<X<Y<Z
B.简单离子的氧化性:W> X
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:
N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。
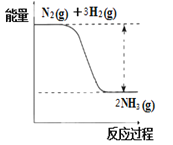
该反应是___________反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_____(填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是___________(填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C. N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
(2)容器容积为1L,T2℃在起始体系中加入1 mol N2 、3molH2,经过5 min反应达到平衡时放55.44kJ。保持容器体积和温度不变,若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q___110.88 kJ(填“>”、“<”或“=”)。
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
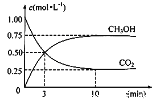
达平衡时容器内平衡时与起始时的压强之比___。
(4)有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g) △H>0。
FeO(s) + CO(g) △H>0。
①若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=______________(保留二位有效数字)。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。升高温度________________;再通入CO_________________。
③该反应的逆反应速率随时间变化的关系如图:
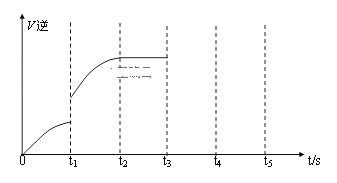
从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)______________。(单选)
A.升温 B.增大CO2浓度
④如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。
标注。
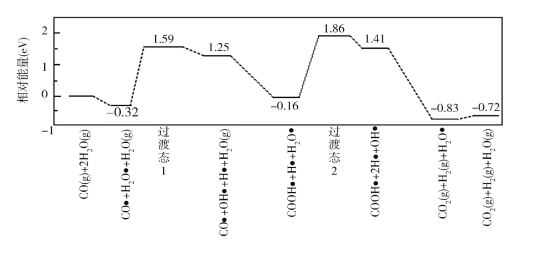
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
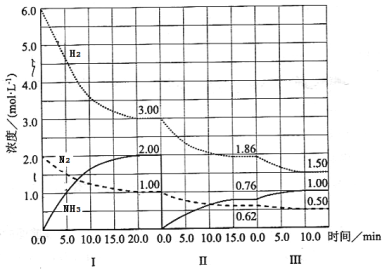
回答问题:
(1)在3个阶段中,N2的平均反应速率![]() (N2)、
(N2)、![]() (N2)、
(N2)、![]() (N2)中最大的是 ,其值是 。
(N2)中最大的是 ,其值是 。
(2)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是 。
(3)由第一次平衡到第二次平衡,平衡移动的方向是 (填“正反应方向”或“逆反应方向”),采取的措施是 。
(4)第Ⅰ阶段时,化学平衡常数K1= ;第Ⅱ、Ⅲ阶段化学平衡常数K2 K3;(填“>、<、=”)判断的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
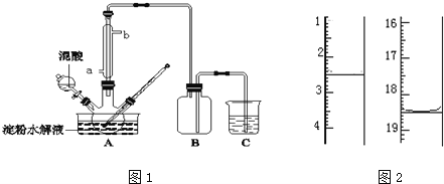
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:
①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI | 溶液变蓝色 | 氧化性:IO |
B | 向稀氨水和酚酞混合溶液中加入少量Ag2O,振荡 | 溶液由浅红色变为红色 | Ag2O是强碱 |
C | 向装有经过硫酸处理的CrO3(桔红色)的硅胶导管中吹入乙醇蒸气 | 固体逐渐由桔红色变为浅绿色(Cr3+) | 乙醇具有还原性 |
D | 向盛有少量水的烧杯中加入少量Mg2Si | 产生白色沉淀,液面上有火苗 | Mg2Si水解生成Mg(OH)2和SiH4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中的氮氧化物是造成大气污染的重要因素。
(1)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为___。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1所示。
①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____。
②NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示。请写出NO分解的化学方程式:______。

(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验,实验结果如图3。
①同时脱硫脱硝时NO的氧化率略低的原因是____。
②由图3可知SO2对NO的氧化率影响很小的原因是_____。

(4)有人设想采用下列方法减少烟气中的氮氧化物对环境的污染:用天然气中的CH4、H2等还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NOx。请写出这种含硫化合物和NOx反应的化学方程式:_____。
(5)某工业废水中含有毒性较大的CN-,可用电解法将其转变为N2,装置如图4所示。电解池中生成N2的电极反应式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com