
| A、弱酸性NaHSO3溶液:c(HSO3-)>c(Na+)>c(H+)>c(OH-) |
| B、0.1mol/LNH4HS溶液:c(NH4+)=c(HS-)+c(H2S)+c(S2-) |
| C、0.2 mol/LNH3?H2O溶液与0.1mol/L盐酸等体积混合:c(NH4+)>c(C1-)>c(OH-)>c(H+) |
| D、0.2mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合:(H+)=c(OH-)+c(HCO3-)+2c(H2CO3) |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 现象或事实 | 解释 |
| A | 用活性炭去除冰箱中的异味 | 活性炭具有吸附性 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的Ca(ClO)2与空气中的 CO2及H2O反应生成CaCO3和HClO,HClO易分解 |
| C | FeCl3溶液可用于制作铜质印刷线路板 | FeCl3溶液能将铜氧化为Cu2+ |
| D | 用热碱水清除炊具上残留的油污 | Na2CO3可和油污直接发生反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4是具有磁性的黑色晶体 |
| B、Al2O3能溶于酸和强碱,是两性氧化物 |
| C、Na2O是碱性氧化物,可与H2O、CO2反应 |
| D、FeO不稳定,在空气中受热迅速被氧化为Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
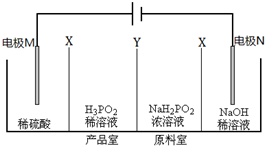
| A、NaH2PO2溶液一定呈碱性 |
| B、图中X为阳膜,Y为阴膜 |
| C、电极M上的反应为:4OH --4e-=O2↑+2H2O |
| D、电解过程中,H+会从阳极室穿过X膜扩散至产品室,Na+会从阴极室扩散至原料室 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解过程中,溶液的pH不断增大 |
| B、当转移0.4mol 电子时,电解生成的铜为12.8g |
| C、阴极反应式为2H2O+4e-=4H++O2↑ |
| D、整个过程中产生的H2与O2的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属单质燃烧时火焰均为无色 |
| B、只有金属单质灼烧时火焰才有颜色 |
| C、焰色反应均应透过蓝色钴玻璃观察 |
| D、NaC1与Na2CO3灼烧时火焰颜色相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com