
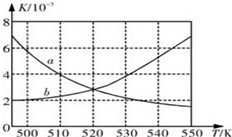
 ¢ń£ŗĪŖĮĖ¼õÉŁCOµÄÅÅ·Å£¬Ä³»·¾³ŃŠ¾æŠ”×éŅŌCOŗĶH2 ĪŖŌĮĻŗĻ³ÉĒå½ąÄÜŌ“¶ž¼×ĆŃ£ØDME£©£¬·“Ó¦ČēĻĀ£ŗ4H2£Øg£©+2CO£Øg£©
¢ń£ŗĪŖĮĖ¼õÉŁCOµÄÅÅ·Å£¬Ä³»·¾³ŃŠ¾æŠ”×éŅŌCOŗĶH2 ĪŖŌĮĻŗĻ³ÉĒå½ąÄÜŌ“¶ž¼×ĆŃ£ØDME£©£¬·“Ó¦ČēĻĀ£ŗ4H2£Øg£©+2CO£Øg£©| Ź±¼ä/min | 0 | 20 | 40 | 80 | 100 |
| n£ØH2£©/mol | 2.0 | 1.4 | 0.85 | 0.4 | - |
| n£ØCO£©/mol | 1.0 | - | 0.425 | 0.2 | 0.2 |
| n£ØCH3OCH3£©/mol | 0 | 0.15 | - | - | 0.4 |
| n£ØH2O£©/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
·ÖĪö ¢ń£ŗ£Ø1£©·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāÄęĻņŅĘ¶Æ£¬Ę½ŗā³£Źż¼õŠ”£»
£Ø2£©¢ŁŅĄ¾ŻĶ¼±ķŹż¾ŻŅĄ¾ŻĘ½ŗāČż¶ĪŹ½ĮŠŹ½¼ĘĖćCOĘ½ŗāÅØ¶Č£¬øł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖćv£ØCO£©£»
¢ŚŅĄ¾ŻĶ¼±ķŹż¾ŻæÉÖŖ80minŗó“ļµ½Ę½ŗā£¬ŅĄ¾ŻĘ½ŗāČż¶ĪŹ½ĮŠŹ½¼ĘĖćH2×Ŗ»»Į棬øł¾Ż$\frac{{H}_{2}µÄ×Ŗ»ÆĮæ}{{H}_{2}µÄ×ÜĮæ}$¼ĘĖćH2µÄ×Ŗ»ÆĀŹ£»
¢Ūøł¾Ż»ÆŃ§Ę½ŗā³£ŹżÓėÅضČÉĢµÄĻą¶Ō“óŠ”ÅŠ¶Ļ·“Ó¦·½Ļņ£¬Čē¹ūÅضČÉĢŠ”ÓŚĘ½ŗā³£Źż£¬ŌņĘ½ŗāĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬·“Ö®£¬Äę·“Ó¦·½Ļņ½ųŠŠ£»
£Ø3£©øĆČ¼ĮĻµē³ŲÖŠ£¬ĶØČėCOµÄŅ»¼«ĪŖŌµē³ŲµÄøŗ¼«£¬·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦Ź½ĪŖ£ŗ2CO+2CO32--4e-=4CO2£¬æÕĘųÓėCO2 µÄ»ģŗĻĘųĢåŅ»¼«ĪŖŌµē³ŲµÄÕż¼«£¬·¢Éś»¹Ō·“Ó¦£¬µē¼«·“Ó¦Ź½ĪŖ£ŗO2+4e-+2CO2=2CO32-£»øł¾Ż×Ü·“Ó¦Ź½ĪŖ2CO+O2=2CO2Ą“½ā“š£»
¢ņ£ŗøł¾ŻČܶȻż³£ŹżČ·¶ØĻČ³ĮµķµÄĪļÖŹ£¬ČܶȻż³£ŹżŌ½Š”µÄĪļÖŹŌ½ĻČ³Įµķ£¬ĶĄė×ÓŗĶ°±Ė®·“Ӧɜ³ÉĒāŃõ»ÆĶŗĶļ§øłĄė×Ó£»
½ā“š ½ā£ŗ¢ń£ŗ£Ø1£©·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāÄęĻņŅĘ¶Æ£¬Ę½ŗā³£Źż¼õŠ”£¬Ę½ŗā³£ŹżKĖęĪĀ¶Č±ä»Æ¹ŲĻµµÄĒśĻßĪŖa£¬¹Ź“š°øĪŖ£ŗa£»Õż·“Ó¦·ÅČČ£¬ĪĀ¶ČÉżøߣ¬Ę½ŗā³£Źż¼õŠ”£»
£Ø2£©¢Ł4H2£Øg£©+2CO£Øg£©?CH3OCH3£Øg£©+H2O£Øg£©
ĘšŹ¼Įæ£Ømol/L£© 1 0.5 0 0
±ä»ÆĮæ£Ømol/L£© 0.3 0.15 0.075 0.075
20minŗóµÄĮæ£Ømol/L£©0.7 0.35 0.075 0.075
ĖłŅŌv£ØCO£©=$\frac{0.15mol/L}{20min}$=7.5”Į10-3mol/£ØL•min£©£»
¹Ź“š°øĪŖ£ŗ7.5”Į10-3£»
¢ŚŅĄ¾ŻĶ¼±ķŹż¾ŻæÉÖŖ80minŗó“ļµ½Ę½ŗā£¬Ōņ
4H2£Øg£©+2CO£Øg£©?CH3OCH3£Øg£©+H2O£Øg£©
ĘšŹ¼Įæ£Ømol£© 2 1 0 0
±ä»ÆĮæ£Ømol£© 1.6 0.8 0.4 0.4
80minŗóµÄĮæ£Ømol£© 0.4 0.2 0.4 0.4
ĖłŅŌH2µÄ×Ŗ»ÆĀŹĪŖ$\frac{1.6mol}{2mol}$”Į100%=80%£»
¹Ź“š°øĪŖ£ŗ80%£»
¢Ū80minŗó£¬c£ØH2£©=0.2mol/L”¢c£ØCO£©=0.1mol/L”¢c£ØCH3OCH3£©=0.2mol/L£¬c£ØH2O£©=0.2mol/L£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK=$\frac{0.2”Į0.2}{0£®{2}^{4}”Į0£®{1}^{2}}$=2500£¬ŌŚÉĻŹöĪĀ¶ČĻĀ£¬ĻņĘ½ŗāŗóµÄ2LČŻĘ÷ÖŠŌŁ³äČė0.4molH2 ŗĶ0.4molCH3OCH3 £Øg£©£¬Ōņc£ØH2£©=0.4mol/L”¢c£ØCO£©=0.1mol/L”¢c£ØCH3OCH3£©=0.4mol/L£¬c£ØH2O£©=0.2mol/L£¬ÅضČÉĢQ=$\frac{0.4”Į0.2}{0£®{4}^{4}”Į0£®{1}^{2}}$=312.5£¬ĖłŅŌĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£»
¹Ź“š°øĪŖ£ŗÕżĻņ£»
£Ø3£©øĆČ¼ĮĻµē³ŲÖŠ£¬ĶØČėCOµÄŅ»¼«ĪŖŌµē³ŲµÄøŗ¼«£¬·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦Ź½ĪŖ£ŗ2CO+2CO32--4e-=4CO2£»Č¼ĮĻµē³ŲµÄµēĀ·ÖŠÓŠ0.2NAøöµē×Ó·¢Éś×ŖŅĘ£¬ÓÉ2CO+O2=2CO2æÉÖŖÉś³É0.1molCO2£¬±źæöĻĀ2.24Éż£»
¹Ź“š°øĪŖ£ŗ2CO+2CO32--4e-=4CO2£»2.24£»
¢ņ£ŗŅņĒāŃõ»ÆĶµÄČܶȻżŠ”ÓŚĒāŃõ»ÆĆ¾µÄČܶȻż£¬ĖłŅŌĒāŃõ»ÆĶĻČ³Įµķ£¬ĶĄė×ÓŗĶ°±Ė®·“Ӧɜ³ÉĒāŃõ»ÆĶ³ĮµķŗĶļ§øłĄė×Ó£¬Ąė×Ó·½³ĢŹ½ĪŖ£ŗCu2++2NH3•H2O?Cu£ØOH£©2”ż+2NH4+£®
¹Ź“š°øĪŖ£ŗCu£ØOH£©2£»Cu2++2NH3•H2O?Cu£ØOH£©2”ż+2NH4+£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»Æѧ·“Ó¦ĖŁĀŹ”¢×Ŗ»ÆĀŹµÄ¼ĘĖć”¢ÅضČÉĢµÄŌĖÓĆŅŌ¼°µē¼«·“Ó¦Ź½µÄŹéŠ“”¢KspµÄ¼ĘĖć£¬×¢Ņāøł¾ŻČܶȻż³£ŹżČ·¶ØĻČ³ĮµķµÄĪļÖŹ£¬ČܶȻż³£ŹżŌ½Š”µÄĪļÖŹŌ½ĻČ³ĮµķŅŌ¼°»ÆŃ§Ę½ŗā³£ŹżÓėÅضČÉĢÖ®¼äµÄ¹ŲĻµĄ“·ÖĪö½ā“š£¬ĢāÄæÄѶČÖŠµČ£®


 ѧ¶ųÓÅŹīĘŚĻĪ½ÓÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø
ѧ¶ųÓÅŹīĘŚĻĪ½ÓÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø Happy holiday»¶ĄÖ¼ŁĘŚŹī¼Ł×÷Ņµ¹ć¶«ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
Happy holiday»¶ĄÖ¼ŁĘŚŹī¼Ł×÷Ņµ¹ć¶«ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČ»ÆĒāŹĒĒæµē½āÖŹ£¬“×ĖįŹĒČõµē½āÖŹ£¬ŃĪĖįČÜŅŗµÄµ¼µēŠŌŅ»¶ØĒæÓŚ“×ĖįČÜŅŗ | |
| B£® | ²»ĀŪŹĒÅØĻõĖį»¹ŹĒĻ”ĻõĖį£¬ÓėĶ·“Ó¦¾łĢåĻÖ³öĻõĖįµÄĖįŠŌŗĶĒæŃõ»ÆŠŌ | |
| C£® | SO2”¢NO”¢NO2¶¼ŹĒŠĪ³ÉĖįÓźµÄŅņĖŲ£¬¶¼ÄÜŗĶĖ®·“Ӧɜ³ÉĖį | |
| D£® | ĀČŌŖĖŲµÄ·Ē½šŹōŠŌĒæÓŚĢ¼ŌŖĖŲ£¬ĀČŌŖĖŲŗ¬ŃõĖįµÄĖįŠŌ¶¼“óÓŚĢ¼ŌŖĖŲµÄŗ¬ŃõĖįµÄĖįŠŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ²ā0.1 mol/L°±Ė®µÄpHĪŖ11£ŗNH3•H2O?NH4++OH- | |
| B£® | ½«Naæé·ÅČėĖ®ÖŠ£¬²śÉśĘųĢå£ŗ2Na+2H2OØT2NaOH+H2”ü | |
| C£® | ÓĆCuCl2ČÜŅŗ×öµ¼µēŹµŃ飬µĘÅŻ·¢¹ā£ŗCuCl2ØTCu2++2Cl- | |
| D£® | AlʬČÜÓŚNaOHČÜŅŗÖŠ£¬²śÉśĘųĢå£ŗ2Al+2OH-+2H2OØT2AlO2-+3H2”ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ³£ĪĀĻĀ½«pH=12µÄ°±Ė®¼ÓĖ®Ļ”ŹĶ£¬Ļ”ŹĶ¹ż³ĢÖŠČÜŅŗÖŠ$\frac{c£ØO{H}^{-}£©}{c£ØN{H}_{3}•{H}_{2}O£©}$¼õŠ” | |
| B£® | Ķ¬ÅØ¶ČµÄ“×ĖįÄĘŗĶ“×ĖįµČĢå»ż»ģŗĻŅŗÖŠ£ŗc£ØNa+£©£¾c£ØCH3COO-£©£¾c£ØH+£©£¾c£ØOH-£© | |
| C£® | 25”ęĻąĶ¬pHµÄ¢ŁCH3COONa¢ŚNaHCO3¢ŪNaAlO2ČżÖÖČÜŅŗÖŠµÄc£ØNa+£©£ŗ¢Ł£¾¢Ś£¾¢Ū | |
| D£® | ÅØ¶Č¾łĪŖ0.1mol•L-1µÄKHSŗĶHClµČĢå»ż»ģŗĻŅŗÖŠ£ŗc£ØHS-£©+c£ØH2S£©=0.1mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
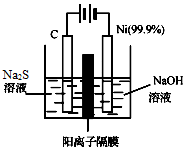 Įņ¼°Ęä»ÆŗĻĪļ¹ć·ŗ·Ö²¼ÓŚ×ŌČ»½ēÖŠ£¬ĮņĖį¹¤ŅµŌŚ¹śĆń¾¼ĆÖŠÕ¼ÓŠ¼«ĘäÖŲŅŖµÄµŲĪ»£¬ŌĖÓĆĻą¹ŲŌĄķ»Ų“šĻĀĮŠĪŹĢā£ŗ
Įņ¼°Ęä»ÆŗĻĪļ¹ć·ŗ·Ö²¼ÓŚ×ŌČ»½ēÖŠ£¬ĮņĖį¹¤ŅµŌŚ¹śĆń¾¼ĆÖŠÕ¼ÓŠ¼«ĘäÖŲŅŖµÄµŲĪ»£¬ŌĖÓĆĻą¹ŲŌĄķ»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ė®Äą | B£® | ľ²Ä | C£® | ĢÕ“É | D£® | ĀĮŗĻ½š |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ž¢ß | B£® | ¢Ū¢Ž¢ß | C£® | ¢Ū¢ß | D£® | ¢Ü¢Ż¢ß |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
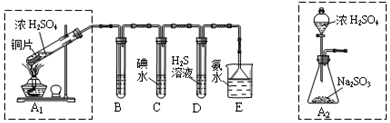
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ś¢Ü | B£® | ¢Ł¢Ś¢Ü | C£® | ¢Ł¢Ū¢Ż | D£® | ¢Ś¢Ū¢Ż |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com