
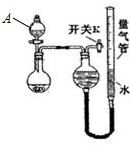
 镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:
镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:| 编号 | 粉末质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 2.0 g | 10.0 mL | 346.2 mL |
| ② | 2.0 g | 10.0 mL | 335.0 mL |
| ③ | 2.0 g | 10.0 mL | 345.8 mL |
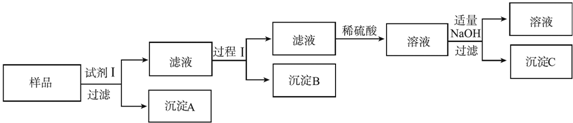
分析 (2)Wg镁铝锌合金加入稀硫酸溶解生成硫酸镁、硫酸铝溶液、硫酸锌溶液,加入试剂M为过量氢氧化钠溶液,得到沉淀A为Mg(OH)2,滤液为Na2ZnO2,NaAlO2溶液,加入过量稀硫酸得到硫酸铝溶液、硫酸锌溶液,再加入足量氨水溶液得到沉淀B为Al(OH)3,滤液为Zn2+易形成配合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+,加入适量氢氧化钠溶液得到C为氢氧化锌沉淀.
解答 解:(2)Wg镁铝锌合金加入稀硫酸溶解生成硫酸镁、硫酸铝溶液、硫酸锌溶液,加入试剂M为过量氢氧化钠溶液,得到沉淀A为Mg(OH)2,滤液为Na2ZnO2,NaAlO2溶液,加入过量稀硫酸得到硫酸铝溶液、硫酸锌溶液,再加入足量氨水溶液得到沉淀B为Al(OH)3,滤液为Zn2+易形成配合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+,加入适量氢氧化钠溶液得到C为氢氧化锌沉淀;
①上述分析可知,试剂M为氢氧化钠溶液,沉淀B为Al(OH)3;
故答案为:NaOH溶液;Al(OH)3;
②操作Ⅰ是:在滤液中逐滴加入稀硫酸溶液直至生成的沉淀刚好溶解,再加入足量的氨水溶液沉淀铝离子,过滤得到氢氧化铝沉淀.
故答案为:稀硫酸;稀氨水;
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3•H2O,沉淀C与氨水反应的离子方程式为Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-;或Zn(OH)2+4NH3•H2O=[Zn(NH3)4]2++2OH-+4H2O;
故答案为:Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-;或Zn(OH)2+4NH3•H2O=[Zn(NH3)4]2++2OH-+4H2O.
点评 本题考查了实验探究物质组成的实验设计,反应过程分析判断,物质提纯的理解应用,主要是混合物分离的方法和物质性质的理解应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 | |
| B. | 增大反应物浓度,能增大活化分子百分数,所以反应速率增大 | |
| C. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| D. | 100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3(m-n) mL | B. | $(m+\frac{n}{3})$ mL | C. | $\frac{n-m}{3}$ mL | D. | $\frac{4n-m}{12}$ mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和碳酸钠 | B. | 氧化铜和稀硝酸 | C. | 碳和浓硫酸 | D. | 铜和浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 苯氧乙酸甲酯的分子式为C9H10O3 | |
| B. | 苯氧乙酸与邻羟基苯乙酸不互为同分异构体 | |
| C. | 苯酚和邻羟基苯乙酸可用FeCl3溶液检验 | |
| D. | ClCH2COOH与足量烧碱溶液共热所得有机物为HOCH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水淡化的主要方法有蒸馏法、电渗析法、离子交换法、反渗透法等 | |
| B. | 海水中的无机盐主要以Na+、Mg2+、K+、Ca2+、SO42-、Cl-、Br-等形式存在 | |
| C. | 海生植物如海带中存在较高浓度的I2,具有很高的开发利用价值 | |
| D. | 从海水中可以提取核反应材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO3)=0.4 mol/L | B. | c(SO2)=c(SO3)=0.15 mol/L | ||
| C. | c(O2)=0.35 mol/L | D. | c(SO2)+c(SO3)=0.4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
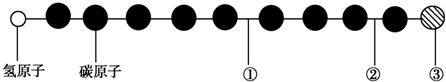
| A. | 该物质是烃的含氧衍生物 | B. | ①处的化学键是碳碳双键 | ||
| C. | ②处的化学键是碳碳单键 | D. | ③处的原子可能是氯原子或氟原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com