
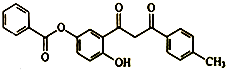
| A. | 分子中含醚键,不含手性碳原子 | |
| B. | 在空气中易被氧化变质 | |
| C. | 能发生取代、加成、消去反应 | |
| D. | 1mol该物质最多能与3mol NaOH溶液发生反应 |
分析 A.该分子中含有酯基、酚羟基和羰基,连接四个不同原子或原子团的C原子为手性碳原子;
B.酚羟基易被空气氧化;
C.该物质中含有酯基、酚羟基和羰基及苯环,具有酯、酚、酮和苯的性质;
D.能和NaOH反应的有酯基水解生成的羧基和酚羟基、酚羟基.
解答 解:A.该分子中含有酯基、酚羟基和羰基,不含醚键,连接四个不同原子或原子团的C原子为手性碳原子,该分子中没有手性碳原子,故A错误;
B.酚羟基易被空气氧化,所以在空气中易被氧化而变质,故B正确;
C.该物质中含有酯基、酚羟基和羰基及苯环,具有酯、酚、酮和苯的性质,酯基和酚羟基能发生取代反应,苯环和羰基能发生加成反应,不能发生消去反应,故C错误;
D.能和NaOH反应的有酯基水解生成的羧基和酚羟基、酚羟基,所以1mol该物质最多能与3mol NaOH溶液发生反应,故D正确;
故选BD.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,易错选项是D,注意酯基水解生成酚羟基,题目难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| C. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、氯乙烯、苯乙烯都是不饱和烃,均可用于合成有机高分子材料 | |
| B. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 | |
| C. | 酒越陈越香是因为酒中含有的有机酸与乙醇生成了酯 | |
| D. | 糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应中转移的电子为n mol,则n一定大于0.15 mol | |
| B. | n(NaCl):n(NaClO):n(NaClO3)可能为7:2:1 | |
| C. | 与NaOH反应的氯气一定为0.15 mol | |
| D. | n(Na+):n(Cl-) 可能为7:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3- | B. | NO3- | C. | NH${\;}_{4}^{+}$ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
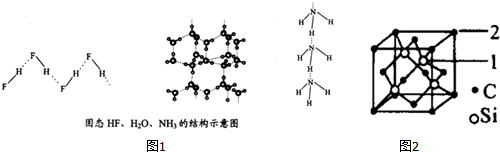
| 物质 | 氢键X-H…Y | 键能KJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N-H键键能的含义是把1molNH3中的共价键全部拆开所吸收的能量 | |
| B. | ClO-的空间构型为平面三角形 | |
| C. | 卤素单质从F2到I2,在常温常压下的聚集状态由气态、液态到固态的原因是原子半径逐渐增大 | |
| D. | 熔点由高到低的顺序为:金刚石>MgO>NaCl>CCl4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com