
 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.分析 (1)在测量收集到O2的体积时,先将装置中的气体冷却至室温,否则气体受热膨胀时,会使读出的体积偏大.然后调整量筒高度,使量筒内液面和集气瓶中液面相平,以保证集气瓶中气体的压强和外界大气压相等,最后再读取量筒内水的体积即为产生O2的体积.读数时若仰视量筒内的液面会使读数偏小,即读取O2的体积偏小;
(2)根据质量守恒定律,反应前试管与药品的总质量减去反应后试管与残留物的质量即可得产生O2的质量为15.95 g-15.55 g=0.4 g,n(O2)=$\frac{0.4g}{32g/mol}$=0.012 5 mol,结合Vm=$\frac{V}{n}$计算O2的摩尔体积.
解答 解:(1)在测量收集到O2的体积时,先将装置中的气体冷却至室温,否则气体受热膨胀时,会使读出的体积偏大.然后调整量筒高度,使量筒内液面和集气瓶中液面相平,以保证集气瓶中气体的压强和外界大气压相等,最后再读取量筒内水的体积即为产生O2的体积,则操作顺序为②①③;
读数时若仰视量筒内的液面会使读数偏小,即读取O2的体积偏小,
故答案为:②①③;偏小;
(2)根据质量守恒定律,反应前试管与药品的总质量减去反应后试管与残留物的质量即可得产生O2的质量为15.95 g-15.55 g=0.4 g,n(O2)=$\frac{0.4g}{32g/mol}$=0.012 5 mol,O2的摩尔体积$\frac{0.2797L}{0.0125mol}$=22.38 L/mol,
故答案为:0.0125;22.38 L/mol.
点评 本题考查实验装置的综合应用及摩尔体积测定,为高频考点,把握实验装置的作用、物质的量计算等为解答的关键,侧重分析与应用、计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| B. | 除短周期外,其它周期均为18种元素 | |
| C. | 乙元素的族序数比甲元素的族序数小 | |
| D. | 甲、丙元素最高价氧化物对应水化物的酸性强弱:甲<丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
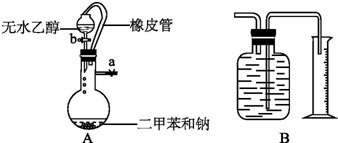
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4溶于水的部分能够电离,所以BaSO4是电解质 | |
| B. | SO2的水溶液能够导电,所以SO2是电解质 | |
| C. | 液态Cl2不导电,所以Cl2是非电解质 | |
| D. | 盐酸能导电,所以盐酸是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
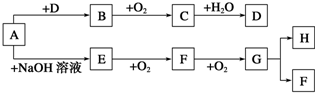
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com