
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
分析 (1)①分析相同时间内氢气体积的多少来判断速率的快慢;
②利用速率表达式v=$\frac{△c}{△t}$计算速率;
③形成原电池可加快反应速率;
(2)①因探究酸浓度对速率的影响,故其他条件相同;
②实验Ⅰ二氧化锰是过氧化氢分解的催化剂,而加入硫酸后,二氧化锰为氧化剂,反应原理不同;
③分析酸的用量和反应时间的关系.
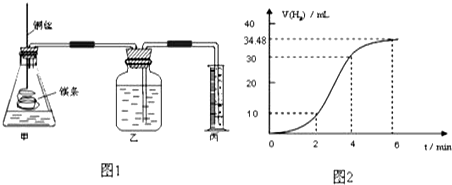
解答 解:(1)①从图中看出2-4分钟内产生氢气最多,故这段时间内反应速率最大,
故答案为:B;
②4-6分钟内,产生氢气4.48mL,物质的量为:$\frac{4.48×1{0}^{-3}L}{22.4L•mo{l}^{-1}}$=2×10-4mol,根据反应方程式:
Mg+2HCl=MgCl2+H2↑可知,参加反应盐酸的物质的量为:4×10-4mol,盐酸的浓度变化为:△c=$\frac{△n}{△t}$=$\frac{4×1{0}^{-4}mol}{2L}$=2×10-4mol/L
v(HCl)=$\frac{△c}{△t}$=$\frac{2×1{0}^{-4}mol•{L}^{-1}}{2min}$=1×10-4mol/(L•min);
故答案为:1×10-4mol/(L•min);
③铜与盐酸不反应,但加入的铜丝和镁及电解质形成原电池,加快了反应速率,
故答案为:A;
(2)①因探究酸浓度对速率的影响,故其他条件相同,10%H2O2的体积不变,混合溶液的总体积不变,所以V1=V2=5.0mL,V3=(20-5.0-13.5)mL=1.5mL;
故答案为:5.0;1.5;
②实验Ⅰ中二氧化锰是过氧化氢分解的催化剂,而加入硫酸后,二氧化锰为氧化剂,反应原理不同,实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,
故答案为:实验I中MnO2将作为催化剂,其他三组实验中二氧化锰作氧化剂,反应原理不同,且酸量不同;
③从数据可看出,酸用量越多,酸的浓度越大,所需时间越短,
故答案为:酸浓度越大,反应速率越快.
点评 本题考查了反应速率的测定及影响因素,中等难度,注意在比较外界反应条件对反应速率的影响时,要限定其他条件相同,改变一个条件,这是解题的依据.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | C原子采取sp3杂化,O原子采取sp杂化 | |
| B. | 甲醛分子中中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构 | |
| C. | 甲醛分子与水分子间可以形成氢键 | |
| D. | 甲醛分子为非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某稀醋酸溶液的pH为3.5 | |
| D. | 用0.2000mol•L-1HCl溶液滴定20.00mL未知浓度NaOH,用去22.40mL HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | V(Na2S2O3)/mL | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | V(H2O)/mL |
| ① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
| ③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
| ④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③⑥ | C. | ①②⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是离子化合物 | B. | 加热时,它很稳定,不发生分解 | ||
| C. | 它能跟碱发生反应 | D. | 它可由PH3和HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得电子能力:A>B>Cm+>Dn+ | B. | 还原性:An->Bm->C>D | ||
| C. | 原子半径:D>C>B>A | D. | 离子半径:An->Bm->Cm+>Dn+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com