
【题目】下列化合物中,阴离子半径与阳离子半径之比最小的是( )
A. LiI B. NaBr C. KCl D. CsF
科目:高中化学 来源: 题型:
【题目】近年来,科学家、合成了一系列具有独特化学性质的氢铝化合物(AlH3)n,常用作还原剂。已知,最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量。Al2H6的球棍模型如下图所示。下列说法正确的是
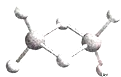
A.Al2H6中Al为-3价,H为+1价
B.Al2H6中含有离子键和极性共价键
C.Al2H6为离子化合物
D.Al2H6在空气中完全燃烧,产物为氧化铝和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
A通常显 价,B元素的核外电子排布式为 。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:

离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(4)某配合物的分子结构如下图所示,其分子内不含有 (填序号)。

A.离子键
B.极性键
C.金属键
D.配位键
E.氢键
F.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的资源宝库,海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钠等。可用于制食盐、Mg、Br2、H2、Cl2、NaOH等化工原料。回答下列问题:
(1)Mg元素位于周期表第______周期_______族。
(2)写出NaOH的电子式_______________。
(3)写出电解饱和食盐水的离子方程式:____________。
(4)海水提溴要经过富集、氧化、提取的过程。其中氧化后生成的Br2可用Na2CO3溶液吸收,生成NaBr和NaBrO3及一种气体,写出该反应的化学方程式__________________。
(5)海水提取镁的过程中,得到MgCl2溶液后,先蒸发浓缩、冷却结晶、过滤制得MgCl2·6H2O,然后在HCl气流中加热得到MgCl2,而不是直接蒸发MgCl2溶液的原因是______________。
(6)海洋底部存在的可燃冰,是可开发的中药能源。常温常压下燃烧3.2g甲烷生成液态水,放出178kJ/mol的热量。写出甲烷燃烧的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应的化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △=-92.3kJ/mol。一定温度下,向体积为2L的密闭容器中加入1mol N2和3mol H2,经2min后达到平衡,平衡时测得NH3的浓度为0.5 mol/L。
2NH3(g) △=-92.3kJ/mol。一定温度下,向体积为2L的密闭容器中加入1mol N2和3mol H2,经2min后达到平衡,平衡时测得NH3的浓度为0.5 mol/L。
(1)2min 内H2的反应速率v(H2)= ;
(2)充分反应并达到平衡时,放出的热量 92.3kJ(填“大于”、“小于”或“等于”)。
原因是 。
(3)下列说法可证明反应达到平衡状态的 。
A.单位时间内,断开1mol N≡N,同时断开3mol H—H
B.单位时间内,形成1mol N≡N,同时形成3mol N—H
C.单位时间内,断开1mol N≡N,同时断开6mol N—H
D.单位时间内,形成1mol N≡N,同时断开3mol H—H
(4)氨的一个重要用途是用于制备火箭发射原料N2H4(肼),已知:火箭发射的原理是N2H4(肼)在NO2中燃烧,生成N2、水蒸气。根据如下反应:
N2(g)+2O2(g)=2NO2(g) △H1=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-534.0kJ/mol
写出在相同状态下,发射火箭反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.合成氨反应中为了提高正反应速率,及时抽走氨气
B.SO2催化氧化中通入过量空气可提高SO2的平衡转化率
C.合成氨中加入催化剂可提高氮气的平衡转化率
D.合成氨反应中缩小容器体积可以使平衡正向移动,所以氮气浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和生活质量的提高。下列各图所示的措施中,是为了增大化学反应速率的是( )。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,它的产量可以衡量一个国家石油化工水平的高低。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。

(1)请写出A的结构简式 ;
(2)写出反应B+C→D的化学方程式 ;
(3)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是 mol;
(4)制备D的实验装置图如图所示:收集产物的试管中盛放的液体为 ;
装置中长颈漏斗除起冷凝作用外,另一重要作用是: 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中含有相同的化学键类型的是
A. NaCl、HCl、H2O、NaOH B. Cl2、Na2S、HCl、SO2
C. Na2O2、H2O2、H2O、O3 D. HBr、CO2、H2O、CS2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com