
高纯度晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场 “革命”。它可以按下列方法制备:
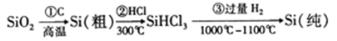
下列说法正确的是
A.步骤①的化学方程式为:SiO2+C Si+CO2↑
Si+CO2↑
B.步骤①②③中每生成或反应1mol Si,转移4mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3
科目:高中化学 来源:2015届安徽省高一上学期期中考试化学试卷(解析版) 题型:选择题
用密度为ρ1g/cm3质量分数是ω的浓盐酸,与水配制成体积比为1:4的稀盐酸,密度为ρ2g/cm3,则所配制稀盐酸的物质的量浓度
A.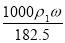 mol/L B.
mol/L B.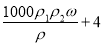 mol/L
mol/L
C.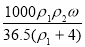 mol/L D.
mol/L D.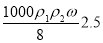 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三第一次联考化学试卷(解析版) 题型:填空题
现有如图所示的转化关系,图中各物质均为常见物质,转化中有部分物质已省略。
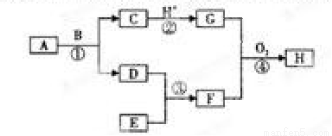
上述物质中C是一种黑色磁性固体,F是极易溶于水且水溶液呈碱性的气体,H是红褐色沉淀,A、D、E均为单质,请回答下列问题:
(1)写出下列物质的化学式:A: 、E
(2)写出④中生成H的非氧化还原反应的离子方程式:
(3)在120℃、1大气压下将168gA和90gB放入1L,密封烧瓶中发生反应①,经过10min达到平衡,平衡后D的质量为4g(固体体积忽略不计),则用D表示10min内的平均反应速率为 ,该温度下此反应的平衡常数K= ,B的转化率是 。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三第一次联考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.“沙尘暴”属于一种自然现象,与人类活动无关
B.碳酸铝是一种应用很广的视频添加剂,可大量添加到馒头、面包、油条等食品中
C.利用垃圾发电能达到节能减排的目的
D.持续高温天气的出现与人类活动无关
查看答案和解析>>
科目:高中化学 来源:2015届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:选择题
同温同压下,等体积的两容器内分别充满14N16O和,13C16O气体,下列对两容器中气体判断正确的是
A.质量相同 B.分子数不同 C.中子数相同 D.质子数相同
查看答案和解析>>
科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:填空题
(17分)Na、Cu、Al、O、C、H是常见的六种元素。
(1)Al位于元素周期表第_____周期第_____族;Cu的基态原子价电子排布式为__________。
(2)用“>”或“<”填空:
第一电离能 | 离子半径 | 沸点 |
Na_______Al | O2—_______Na+ | CH4______H2O |
(3)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物 质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H= 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________.
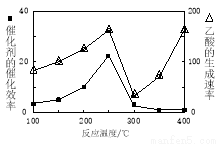
②为了提高该反应中CH4的转化率,可以采取的措施是__________________
(5)利用高温电解技术可将释放的CO2转化为具有工业利用价值的产品。
反应方程式为: ,其工作原理示意图如下:
,其工作原理示意图如下:
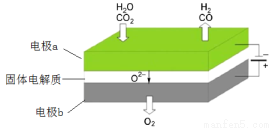
CO2在电极a放电的反应式是_______________________________
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:实验题
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:KSCN溶液、NaOH溶液、氯水、KMnO4 溶液。(1)请完成下表:
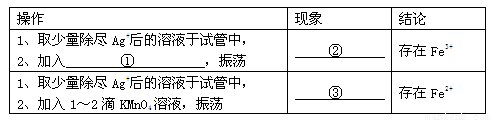
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
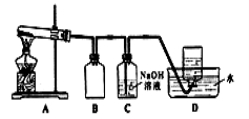
(2)装置B的作用是 。
(3)经小组讨论并验证该无色气体为O2,其验证方法是 。
(4)【查阅资料】Ag2O和Ag的粉末均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:①Ag;②Ag2O;③Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量氨水,振荡 | 黑色固体不溶解 |
b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 (填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的方程式为 。
【实验拓展】测得两组数据:
①取2.0gAgNO3样品充分受热分解,收集到气体体积为56mL;
②取2.0gAgNO3样品充分受热分解,完全分解后测得残留固体产物质量为1.2g;请你选择其中一组数
据,计算样品中AgNO3的百分含量为 。
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期期中考试理科综合化学试卷(解析版) 题型:填空题
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)草酸是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是____________
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-) = 0.1 mol·L-1
C.c(C2O42-) < c(H2C2O4)
D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
(2)0.1 mol·L-1的NaHCO3溶液中存在的平衡有(用离子方程式表示)_____________。
(3)MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是
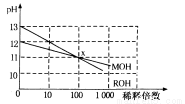
A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
(4)AgCl在溶液中存在如下平衡: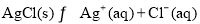 在25℃时,AgCl的
在25℃时,AgCl的
Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3
mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+
浓度由大到小的顺序为_____________(填序号),向50 mL 0.018 mol/L的AgNO3溶液中加
入50 mL 0.02 mol/L的盐酸,沉淀生成后溶液中c(Ag+)是________mol/L。如果向生成沉淀
后的溶液中再加入50 mL 0.001 mol/L的盐酸,是否产生沉淀_______(填“是”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com