
| A. | Na2O | B. | Na2O2 | C. | Na2O和Na2O2 | D. | Na2O2和Na |
分析 钠与氧气反应的生成物溶于水,得到NaOH溶液,再用盐酸恰好转化,此时溶液中溶质为NaCl,根据钠元素、氯元素守恒可知n(Na)=n(NaCl)=n(HCl),进而计算钠与氧气反应产物中n(O),结合Na、O数目之比判断.
解答 解:钠与氧气反应的生成物溶于水,得到NaOH溶液,再用盐酸恰好转化,此时溶液中溶质为NaCl,根据钠元素、氯元素守恒可知n(Na)=n(NaCl)=n(HCl)=0.16L×0.50mol/L=0.08mol,
则n(O)=$\frac{3.0g-23g/mol×0.08mol}{16g/mol}$=0.0725mol,故产物中Na、O原子数目之比=0.08:0.0725≈1.1,介于1:1到2:1之间,
所以一定条件下钠与氧气反应的生成物是Na2O和Na2O2,
故选C.
点评 本题考查混合物计算,题目难度中等,注意利用生成物中Na、O原子数目之比进行判断,学生容易考虑氧化钠、过氧化钠情况,而忽略Na不一定被完全氧化,仅利用氧化物解答可能会导致答案不完全.


科目:高中化学 来源: 题型:选择题
| A. | CaCO3和足量盐酸反应 | |
| B. | Na2CO3溶液和足量醋酸(CH3COOH)反应 | |
| C. | Na2CO3溶液和足量稀硝酸反应 | |
| D. | NaHCO3溶液和足量稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.56L丙烷中含有共价键的数目为2.5NA | |
| B. | 常温常压下,6.4g氧气和臭氧的混合气体中含有的原子总数为0.4NA | |
| C. | 5.6g铁与一定量浓硫酸恰好反应,转移的电子数目可能为0.2NA | |
| D. | 常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
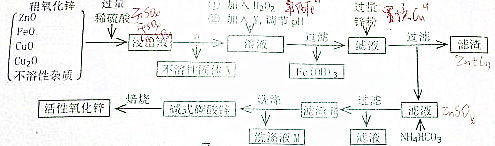
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 主要玻璃仪器 | 试剂 |
| A | 分离乙醇和乙酸混合物 | 蒸馏烧瓶、冷凝管、酒精灯、温度计、锥形瓶 | 乙醇和乙酸混合物 |
| B | 鉴别NH4Cl中的阳离子 | 试管、酒精灯 | NH4Cl、红色石蕊试纸、蒸馏水 |
| C | 实验室制取CO2 | 试管、带导管的橡皮塞 | 大理石、稀H2SO4 |
| D | 测定FeSO4溶液浓度 | 滴定管、锥形瓶、烧杯 | FeSO4溶液、0.1000mol•L-1KMnO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com