
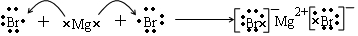 .
.分析 X、Y、Z、A、B、C、D几种元素:
①X、Y、Z是原子核外有3层电子的金属元素,均为第三周期元素,原子半径X<Y<Z,则Z为Na、Y为Mg、X为Al;
②A、B是非金属元素,它们可与氢化合形成气态氢化物H2A和HB.室温时,A的单质为淡黄色固体,B的单质为液态,可知A为S,B为Br;
③C是元素周期表中氧化性最强的元素,C为F元素;
④D的单质是常温下呈液态的金属,D为Hg,以此来解答.
解答 解:由上述分析可知,X为Al,Y为Mg,Z为Na,A为S,B为Br,C为F,D为Hg,
(1)Y在周期表中的位置是第三周期ⅡA族,H2A的名称为硫化氢,故答案为:第三周期ⅡA族;硫化氢;
(2)B单质为溴,颜色为深红棕色,故答案为:深红棕色;
(3)用电子式表示化合物YB2的形成过程为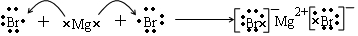 ,
,
故答案为: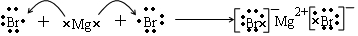 ;
;
(4)C单质与水反应的化学方程式为F2+2H2O=4HF+O2,故答案为:F2+2H2O=4HF+O2;
(5)X单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)D单质的蒸气扩散到空气中会对人体产生危害,通常在洒落的D单质上覆盖硫磺进行处理,反应的化学方程式为Hg+S=HgS,故答案为:Hg+S=HgS.
点评 本题考查位置、结构与性质,为高频考点,把握元素的性质、元素化合物知识来推断元素为解答的关键,侧重分析与应用能力的考查,注意化学用语与元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 | |
| B. | Fe在O2中的燃烧产物可用于制红色涂料 | |
| C. | 瓷坩埚能耐高温,可用于加热熔化烧碱、纯碱等固体 | |
| D. | Mg (OH)2分解吸热且生成高熔点固体,可用作阻燃剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80g硝酸铵中含有氮原子数为NA | |
| B. | 0.lmolN5+离子中所含的电子数为3.4 NA | |
| C. | 2mol金属铝与足量的盐酸反应,共失去了4NA个电子 | |
| D. | 16 g氧气和16 g臭氧所含的原子数均为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
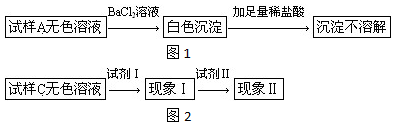
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| B. | 12g石墨和C60的混合物中质子总数一定为6NA | |
| C. | 25℃时,1L mol•L-1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子 | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1 CaCl2溶液 | ||
| C. | 150 mL 3 mol•L-1 KCl溶液 | D. | 75 mL 3 mol•L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com