
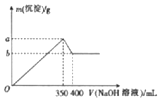
| A. | 8 | B. | 6 | C. | 4 | D. | 2 |
分析 n mol的Sx在足量氧气中完全燃烧,生成xnmol的二氧化硫,产生气体全部通入含有m molCa(OH)2的石灰水中,恰好完全沉淀,生成沉淀亚硫酸钙的物质的量为:mmol,根据亚硫酸钙的组成,所以xn=m,由此分析解答.
解答 解:n mol的Sx在足量氧气中完全燃烧,生成xnmol的二氧化硫,产生气体全部通入含有m molCa(OH)2的石灰水中,恰好完全沉淀,生成沉淀亚硫酸钙的物质的量为:mmol,根据亚硫酸钙的组成,所以xn=m,又因为:8n=m,所以x=8,故选A.
点评 本题考查了化学反应的相关计算,学生要结合化学反应产物,根据原子守恒分析计算判断,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯 | B. | 环丁二烯 | C. | 2-丁炔 | D. | 1-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况).
金属及其化合物在化学中扮演着重要的角色,试根据各物质的性质完成下列问题:(1)钠与水反应时,钠漂浮在水面上.甲同学用刺有小孔的铝箱将0.46g钠包裹,而后投入水中,使钠沉入水底与水(足量)反应.反应结束后,生成的气体体积大于(填“大于”“小于”或“等于”) 224mL (标准状况). CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.
CuSO4+SO2↑+2H2O,生成SO2的物质的量小于0.46mol的原因是随着反应的进行硫酸的浓度逐渐减小,铜不与稀硫酸反应,所以产生SO2的物质的量小于0.46mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在城区内汽车限行,限制燃煤锅炉的使用 | |
| B. | 容易产生扬尘的工厂和建筑工地停工 | |
| C. | 在灰尘较多的道路洒水,以减少扬尘的产生 | |
| D. | 要求市民出行时一定要戴防雾霾专用口罩 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +CH3Br$\stackrel{催化剂}{→}$
+CH3Br$\stackrel{催化剂}{→}$
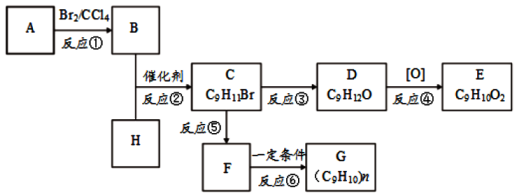


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质编号 | 所属类别编号 | 物质编号 | 所属类别编号 |
| (1) | (4) | ||
| (2) | (5) | ||
| (3) | (6) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
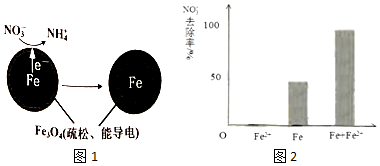
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
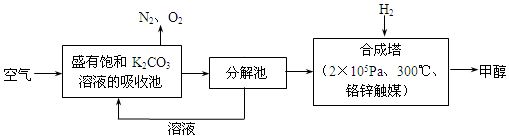

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com