
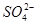 )>c(H+)=c(OH-)(2分)
)>c(H+)=c(OH-)(2分)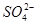 )>c(Na+)>c(OH-)(2分)
)>c(Na+)>c(OH-)(2分)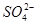 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)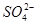 )>c(Na+)>c(OH-)
)>c(Na+)>c(OH-)

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.0.45mo1/L | B.0.25mol/L | C.0.225mol/L | D.0.9mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中不一定含有SO42- |
| B.向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解。 |
| C.等体积的PH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB |
| D.淀粉在稀硫酸的作用下水解后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经完全水解。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.5mol/L | B.0.75mol/L | C.0.5mol/L | D.0.25mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(NH4+)<c(SO42-) | B.c(NH4+)=c(SO42-) |
| C.c(NH4+)>c(SO42-) | D.c(SO42-)+ c(OH-)= c(NH4+)+ c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | HA | NaOH | 混合溶液的pH |
| 甲 | C(HA)=0.2 mol·L-1 | C(NaOH)=0.2mol·L-1 | pH=a |
| 乙 | C(HA)=c1 mol·L-1 | C(NaOH)=0.2mol·L-1 | pH=7 |
| 丙 | C(HA)="0.1" mol·L-1 | C(NaOH)=0.1mol·L-1 | pH=9 |
| 丁 | pH=2 | pH=12 | pH=b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
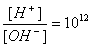 ,将两种溶液等体积混合后,溶液中离子浓度关系正确的是
,将两种溶液等体积混合后,溶液中离子浓度关系正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.人类目前所直接利用的能源大部分是由化学反应产生的 |
| B.煤,石油,天然气是当今世界最重要的三种化石燃料 |
| C.最理想的能源是煤炭 |
| D.人体运动所消耗的能量与化学反应有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com