
| A. | 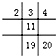 | B. | 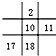 | C. | 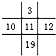 | D. | 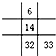 |
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 分子式 | C8H10 | C3H5Cl | C4H8O2 | C4H9ClO |
| 限定条件 | 芳香烃 | 能发生加成反应 | 能与氢氧化钠溶液反应 | 能与钠反应 |
| A. | ③②①④ | B. | ②③①④ | C. | ③①②④ | D. | ②①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
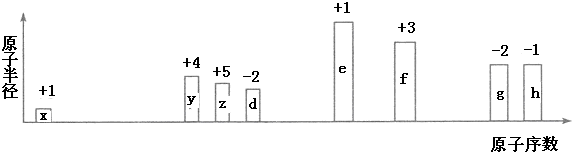
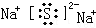 .化合物中离子半径较大的是S2-(填离子符号).
.化合物中离子半径较大的是S2-(填离子符号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
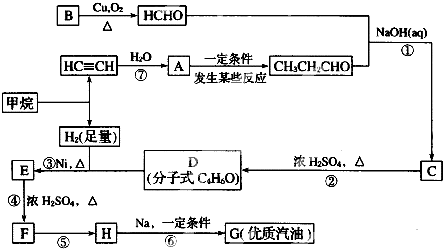
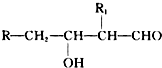
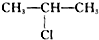
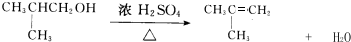 ;H→G
;H→G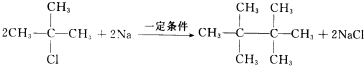 .
.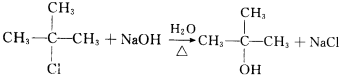 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水可区分乙烯和乙炔 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用金属钠可区分乙醇和乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 离子半径:C>D>B>A | ||
| C. | 原子序数:d>c>b>a | D. | 最外层电子数:D>C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦⑧⑨ | B. | ③⑤⑥⑦⑧⑨ | C. | ②③④⑤⑦⑧ | D. | ①②④⑥⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | K2SO3 | C. | NaOH | D. | Na2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com