
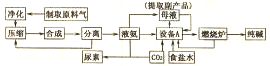
 HCO3-+OH-,溶液显碱性,促进油脂的水解(结合相关离子方程式解释).
HCO3-+OH-,溶液显碱性,促进油脂的水解(结合相关离子方程式解释).分析 (1)合成氨的原料气是N2、H2;反应物为甲烷和水,条件是高温、催化剂,产物之一是氢气,甲烷完全燃烧产物是二氧化碳,不完全燃烧产物为一氧化碳,据此写出即可;
(2)依据反应原理推断设备A中的化学反应方程式,并得出副产物;
(3)依据尿素的化学式和题目所给的额信息结合化学反应原理写出化学反应方程式;
(4)纯碱是Na2CO3,是强碱弱酸盐,在溶液中水解显碱性,而油脂能在碱性条件下水解;
(5)根据流程图来分析;
(6)依据质量分数的计算方法,计算即可.
解答 解:(1)合成氨的原料气是N2、H2;依据题给的信息,甲烷与水在高温催化剂作用下生成二氧化碳(或一氧化碳)和氢气,故化学反应方程式为CH4+2H2O $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CO2+4H2或CH4+H2O$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CO+3H2,故答案为:CH4+2H2O $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CO2+4H2或CH4+H2O$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CO+3H2;
(2)在生产中,设备A中应生成目标产物纯碱,故发生的反应为:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,由于NaHCO3是想得到的产品,故NH4Cl是副产品,故答案为:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓;NH4Cl;
(3)尿素的水解生成两种气体,结合尿素的元素组成,故生成的是氨气和二氧化碳,故反应为:CO(NH2)2+H2O=2NH3↑+CO2↑,故答案为:NaCl;CO(NH2)2+H2O=2NH3↑+CO2↑;
(4)纯碱是Na2CO3,是强碱弱酸盐,在溶液中水解显碱性:CO32-+H2O HCO3-+OH-,而油脂能在碱性条件下水解,故答案为:CO32-+H2O
HCO3-+OH-,而油脂能在碱性条件下水解,故答案为:CO32-+H2O HCO3-+OH-,溶液显碱性,促进油脂的水解;
HCO3-+OH-,溶液显碱性,促进油脂的水解;
(5)根据流程图可知,由于合成氨的反应是可逆反应,不能进行彻底,故N2、H2可以循环利用,NaHCO3及分解产生的CO2也可以循环利用,故答案为:N2、H2、CO2、NaHCO3;
(6)生成mg固体为BaCO3,其物质的量为:$\frac{mg}{197g/mol}$,则碳酸钠的质量为:$\frac{mg}{197g/mol}$×106g/mol=$\frac{106m}{197}$g,
故氯化钠的质量为(w-$\frac{106m}{197}$)g,则氯化钠的质量分数为:$\frac{w-\frac{106m}{197}}{w}$×100%=(1-$\frac{106m}{197w}$)×100%,
故答案为:(1-$\frac{106m}{197w}$)×100%.
点评 本题考查了纯碱的工业制法,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力,明确合成原理为解答关键.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属元素与非金属元素能形成共价化合物 | |
| B. | 只有在原子中,质子数与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 氧和臭氧互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
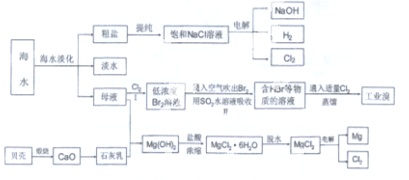
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

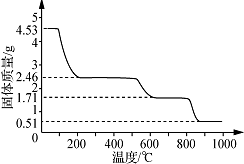
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
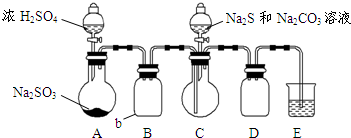 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 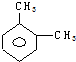 | B. | 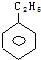 | C. | 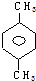 | D. | 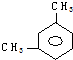 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把电能转变为化学能的装置 | |
| B. | 活泼金属做正极,不活泼金属或非金属做负极 | |
| C. | 外电路中电子从负极流向正极 | |
| D. | 正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅦA族元素形成的单质的熔点随元素原子序数增大而升高 | |
| B. | ⅦA族元素易形成-1价离子 | |
| C. | 最高价氧化物的水化物显酸性 | |
| D. | 从上到下气态氢化物的稳定性依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com