
| A、0.17 | B、0.18 |
| C、0.20 | D、0.21 |
| 6.8g |
| 17g/mol |
| 0.4mol |
| 2 |


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
| A、标况下,2.24L己烷所含分子数为0.1NA |
| B、1mol甲基中电子数为7NA |
| C、在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA |
| D、22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、只有② |
| C、只有①②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
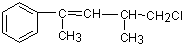 ,关于该有机物叙述不正确的是( )
,关于该有机物叙述不正确的是( )| A、不能使酸性KMnO4溶液褪色 |
| B、能使溴水褪色 |
| C、在加热和催化剂作用下,最多与4 mol H2反应 |
| D、能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度一定时1g饱和硝酸钾溶液中加入1g硝酸钾晶体后,所得溶液的质量 |
| B、1mL酒精与1 mL水混合均匀后所得溶液的总体积 |
| C、1g碳酸钠溶液和1g盐酸溶液反应后溶液的总质量 |
| D、1g酒精和1g水混合后的总质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池的电极只能由两种不同的金属构成 |
| B、锌锰干电池中,锌电极是正极 |
| C、手机上用的锂电池属于二次电池 |
| D、在燃料电池的正极上发生反应的常是可燃性气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ | ||||
B、NH4HCO3溶于过量的NaOH溶液中:HCO
| ||||
C、稀H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO
| ||||
D、AgNO3溶液中加入过量的氨水:Ag++NH3?H2O═AgOH↓+NH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、严禁乱弃废电池,防止重金属污染土壤和水源 |
| B、“84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感 |
| C、钢铁在河水中比在海水中更易生锈 |
| D、向高硫煤中加入生石灰,可减少燃煤对大气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时电解液的密度不断增大 |
| B、放电时电子从Pb通过导线转移到PbO2 |
| C、充电时Pb极与外电源的正极相连 |
| D、充电时PbO2电极发生还原反应,Pb电极上发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com