
| A. | ②③④⑤⑥ | B. | ③④⑤ | C. | ④⑤ | D. | ④⑤⑥ |
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na与乙醇完全反应,失去2NA电子 | |
| B. | 标准状况下,22.4L苯含NA个C6H6分子 | |
| C. | 0.5mol-OH和0.5mol OH-均含有5NA电子 | |
| D. | 常温常压,8gCH4含5NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
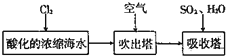
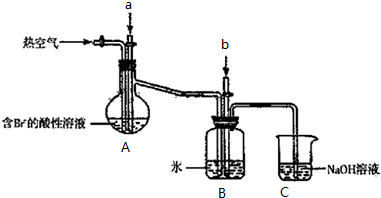
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主族金属元素和非金属元素在不同化合物中都可能呈不同的化合价 | |
| B. | 同一元素不可能既表现金属性,又表现非金属性 | |
| C. | 除氢外的短周期元素形成最高价化合物时,最外层都达到8电子稳定结构 | |
| D. | 同一主族的元素,化学性质也可能差异很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯的分子式:C4H6 | B. | 溴乙烷的电子式: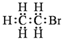 | ||
| C. | 甲醛的结构式: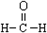 | D. | 葡萄糖的结构简式:CH2OH(CHOH)4CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 第1次 | 第2次 | 第3次 | 第4次 |
| 消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com