
| A. | 多数合金的硬度一般比其各成分金属的硬度高 | |
| B. | 多数合金的熔点一般比其各成分金属的熔点低 | |
| C. | 合金中可以含有非金属元素 | |
| D. | 合金的化学性质一般与其各成分金属的化学性质不同 |
分析 A.合金的硬度比组成它的各成分的硬度都大;
B.合金的熔点比组成它的各成分的熔点都低;
C.合金是由两种或两种以上的金属与金属(或非金属)经一定方法所合成的具有金属特性的物质;
D.合金的化学性质一般与各成分金属的相同.
解答 解:A.合金的硬度一般比其各成分金属的硬度高,故A正确;
B.合金的熔点一般比其各成分金属的熔点低,故B正确;
C.合金是由两种或两种以上的金属与金属(或非金属)经一定方法所合成的具有金属特性的物质.合金材料中一定有金属,也可能含有非金属元素,故C正确;
D.合金的化学性质一般与各成分金属的化学性质相同,故D错误.
故选D.
点评 本题考查合金的性质,难度不大,掌握合金的化学性质一般与各成分金属的化学性质相同是解题的关键.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| B. | 向稀硝酸中加入铁粉完全反应,所得溶液一定只含一种溶质 | |
| C. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| D. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何情况下,温度都不可能对反应的方向起决定性作用 | |
| B. | pH=4的CH3COOH和NH4Cl溶液中,水的电离程度相同 | |
| C. | 用pH试纸测定溶液pH的正确操作是,将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照 | |
| D. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
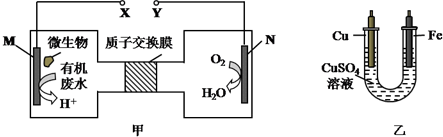
| A. | H十透过质子交换膜由右向左移动 | |
| B. | 铜电极应与X相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25mol气体时,则铁电极增重16g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中的OH-向正极移动 | |
| B. | 在银表面上的反应为:2Al+3Ag2S═6Ag+Al2S3 | |
| C. | 正极反应式为:Ag2S+2e-═2Ag+S2- | |
| D. | 在铝表面的反应为:Al+3OH--3e-═Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
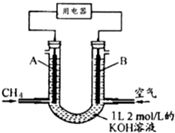 CH4燃料电池,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O.
CH4燃料电池,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| C. | Na2O2的电子式: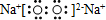 | |
| D. | 乙烯分子的结构简式:CH2CH2. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com