
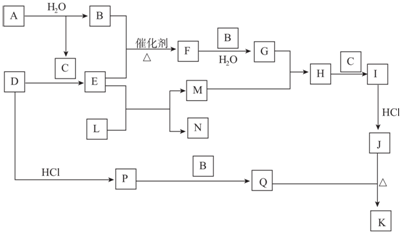
 ,D的化学式(NH4)2S.
,D的化学式(NH4)2S.分析 根据“J、K均是同种金属的氯化物,且K为白色沉淀”则不是铁盐,应是铜盐,即J是CuCl2、K是CuCl,Q是具有刺激性气味、具有还原性的气体,I是CuO或Cu(OH)2,则M是铜,L是氧化铜,E是氨气,N为氮气,B是氧气,F是NO,G是硝酸,H是Cu(NO3)2,联系A与水反应生成B(氧气),则C是NaOH,A为Na2O2,I是Cu(OH)2,D是铵盐,D其中阴离子具有还原性,是弱酸、还原性离子,联系Q知D是(NH4)2S,P是H2S,Q是SO2.
解答 解:根据“J、K均是同种金属的氯化物,且K为白色沉淀”则不是铁盐,应是铜盐,即J是CuCl2、K是CuCl,Q是具有刺激性气味、具有还原性的气体,I是CuO或Cu(OH)2,则M是铜,L是氧化铜,E是氨气,N为氮气,B是氧气,F是NO,G是硝酸,H是Cu(NO3)2,联系A与水反应生成B(氧气),则C是NaOH,A为Na2O2,I是Cu(OH)2,D是铵盐,D其中阴离子具有还原性,是弱酸、还原性离子,联系Q知D是(NH4)2S,P是H2S,Q是SO2.
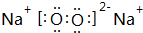
(1)A是Na2O2,电子式为 ,D的化学式是(NH4)2S,
,D的化学式是(NH4)2S,
故答案为: ;(NH4)2S;
;(NH4)2S;
(2)A和P按1:3比例在水溶液中反应的离子方程式:3H2S+Na2O2═2Na++S↓+2HS-+2H2O,
故答案为:3H2S+Na2O2═2Na++S↓+2HS-+2H2O;
(3)B和E反应的方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)Q和J生成K的离子方程式:2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-.
点评 本题考查无机物推断,题目涉及物质较多,物质的颜色为推断突破口,但不是非常明显,尤其是中学不涉及CuCl,需要学生熟练掌握元素化合物性质,难度较大.


科目:高中化学 来源: 题型:选择题
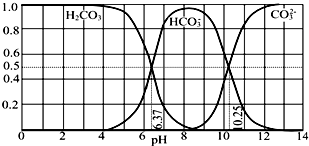
| A. | pH=10.25时,c(Na+)═c(CO32-)+c(HCO3-) | |
| B. | 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间 | |
| C. | 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37 | |
| D. | 若是0.1mol NaOH 反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不与浓硫酸发生反应 | |
| B. | 过氧化钠可作为防毒面具和潜水艇内的供氧剂 | |
| C. | 可用稀硝酸鉴别铜锌合金制成的假金币 | |
| D. | 氢氟酸可用于雕刻玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A=B | B. | A<B | C. | 无法判断 | D. | A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D>B>C>A | |
| B. | 金属性:B>C | |
| C. | A、D最高化合价与最低化合价的代数和分别为0和6 | |
| D. | B和A、C形成的氧化物均不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 白色沉淀A可能能溶解在溶液D | |
| B. | 在甲中滴加丁可能发生反应:HCO3+Ba2++OH-=BaCO3↓+H2O | |
| C. | 溶液丙与I-、N03-、SO42-可以大量共存 | |
| D. | 溶液甲中一定满足:c(H2CO3)+c(H+)═c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯.苯甲酸乙脂 (密度1.05g ?cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等.制备苯甲酸乙脂的过程如下:
苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯.苯甲酸乙脂 (密度1.05g ?cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等.制备苯甲酸乙脂的过程如下:| 沸点(℃,1atm) | ||||||
| 苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环已烷-水-乙醇) |
| 249 | 212.6 | 40-80 | 100 | 78.3 | 80.75 | 62.6 |
 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O仪器a的名称冷凝管,b口的作用为出水口,
+H2O仪器a的名称冷凝管,b口的作用为出水口,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com