
分析 (1)n(Fe)=$\frac{10g}{56g/mol}$=0.179mol,n(H2SO4)=2mol/L×0.05L=0.1mol,二者反应方程式为Fe+H2SO4=FeSO4+H2↑,根据方程式知,Fe过量,以硫酸为标准计算硫酸亚铁的物质的量;
(2)充分反应后生成的氢气c L(标准状况),溶液中有黑色固体剩余.再加入少量稀硫酸,黑色固体不溶解,说明Fe完全反应,根据Fe+H2SO4=FeSO4+H2↑得m(Fe)=n(Fe).M(Fe)=n(H2).M(Fe)=$\frac{c}{22.4}$mol×56g/mol,Fe的质量分数=$\frac{m(Fe)}{m(生铁)}×100%$;
(3)生成硫酸亚铁最少时为Fe和硫酸反应生成氢气,Fe和硫酸铁不反应;生成硫酸亚铁最多时为硫酸根离子完全与亚铁离子结合生成硫酸亚铁,所以生成硫酸亚铁的物质的量大于产生氢气生成的硫酸亚铁的量,小于等于硫酸完全转化为硫酸亚铁的物质的量.
解答 解:(1)n(Fe)=$\frac{10g}{56g/mol}$=0.179mol,n(H2SO4)=2mol/L×0.05L=0.1mol,二者反应方程式为Fe+H2SO4=FeSO4+H2↑,根据方程式知,Fe过量,以硫酸为标准得n(FeSO4)=n(H2SO4)=0.1mol,
故答案为:0.1mol;
(2)充分反应后生成的氢气c L(标准状况),溶液中有黑色固体剩余.再加入少量稀硫酸,黑色固体不溶解,说明Fe完全反应,根据Fe+H2SO4=FeSO4+H2↑得m(Fe)=n(Fe).M(Fe)=n(H2).M(Fe)=$\frac{c}{22.4}$mol×56g/mol,Fe的质量分数=$\frac{m(Fe)}{m(生铁)}×100%$=$\frac{\frac{c}{22.4}mol×56g/mol}{ag}$×100%=$\frac{2.5c}{a}$,
故答案为:$\frac{2.5c}{a}$;
(3)生成硫酸亚铁最少时为Fe和硫酸反应生成氢气,Fe和硫酸铁不反应;生成硫酸亚铁最多时为硫酸根离子完全与亚铁离子结合生成硫酸亚铁,根据Fe+H2SO4=FeSO4+H2↑,则FeSO4~H2↑,所以n(FeSO4)=n(H2)=$\frac{cL}{22.4L/mol}$=$\frac{c}{22.4}$mol,小于等于硫酸完全转化为硫酸亚铁的物质的量,根据硫酸根守恒可知:n(FeSO4)=b×10-3L×2mol/L=2b×10-3mol,所以$\frac{c}{22.4}$mol<n(FeSO4)≤2b×10-3mol,故答案为:$\frac{c}{22.4}$mol;2b×10-3mol.
点评 本题考查化学方程式的计算,为高频考点,侧重考查学生分析计算能力,难点是(3)题的取值范围的计算,把握哪种情况生成的硫酸亚铁最少、哪种情况生成的硫酸亚铁最多是解本题关键,题目难度中等.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:实验题
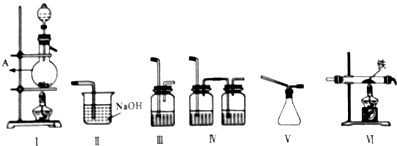
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH平衡时浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | a1 | a2 | a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
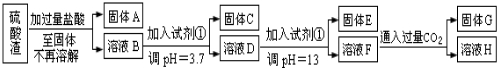
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
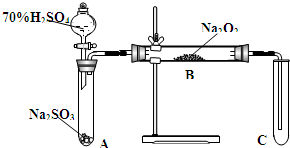 类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
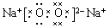
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁原子的电子排布式:[Ar]3d64s2 | B. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | ||
| C. | 氢氧化钠的电子式: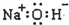 | D. | F的原子结构示意图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com