
| A.都是银白色的软金属,密度都较小 |
| B.单质在空气中燃烧生成的都是过氧化物 |
| C.碱金属单质与水剧烈反应生成碱和氢气 |
| D.单质的熔沸点随着原子序数的增加而升高 |
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源:不详 题型:填空题
| 物质 | NaF | NaCl | NaBr | NaI |
| 熔点/℃ | 995 | 801 | 755 | 651 |
| 物质 | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 |
| 物质 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点/℃ | -70.4 | -49.5 | -36.2 | -15 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.小苏打与烧碱溶液反应: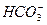 +OH-====CO2↑+H2O +OH-====CO2↑+H2O |
| B.金属钾与水的反应:2K+2H2O====2K++2OH-+H2↑ |
| C.钾与硫酸铜溶液的反应:2K+Cu2++2H2O====Cu(OH)2↓+2K++H2↑ |
D.碳酸钡溶于盐酸中: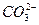 +2H+====CO2↑+H2O +2H+====CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钾比钠更活泼,在反应中更易失去电子,作氧化剂 |
| B.钠比铜活泼,将钠投入CuSO4溶液中有单质铜析出,并产生少量气体 |
| C.钠的熔点较低,其熔点低于水的沸点 |
| D.钠的密度较小,其密度比煤油小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①>②>③ | B.①>③>② | C.②>①>③ | D.①=②=③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定无Na2CO3,可能有FeCl3 | B.可能有Na2CO3和NaCl |
| C.一定有MgCl2,可能有NaCl | D.一定有NaCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径依次增大,离子半径依次减小 |
| B.单质的熔点、沸点依次降低 |
| C.氧化物对应的水化物碱性依次增强 |
| D.单质的还原性依次减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com