
| A | B | C | D | |
| 阳极 | 石墨棒 | Cu | Cu | Cu |
| 阴极 | 石墨棒 | 石墨棒 | Fe | Pt |
| 电解质 溶液 | CuSO4 溶液 | Na2SO4 溶液 | H2SO4 溶液 | CuSO4 溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 实现反应:Cu+2H2O=Cu(OH)2+H↑;利用电解原理使非自发进行的反应能进行反应,依据氧化还原反应的化合价变化,铜元素化合价升高失电子发生氧化反应,做电解池的阳极,水中的氢元素得到电子反应还原反应,在电解池的阴极上发生反应生成氢气.
解答 解:A.惰性电极电解硫酸铜溶液,阳极上氢氧根离子失电子发生氧化反应,阴极上铜离子得到电子析出铜,2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,故A不符合;
B.阳极是铜失电子,阴极是溶液中水电离的氢离子得到电子发生还原反应,电池反应为Cu+2H2O=Cu(OH)2+H2↑,故B符合;
C.阳极是铜失电子,阴极是溶液中酸电离的氢离子得到电子发生还原反应,电池反应为Cu+2H+=Cu2++H2↑,故C不符合;
D.阳极是铜失电子,阴极是溶液中铜离子得电子,没有氢气生成,故D不符合;
故选B.
点评 本题考查了电解原理的应用,利用电解原理实现氧化还原反应,需要分清阳极材料和电解质溶液组成,电极判断,电极反应是解题关键,侧重于考查学生的分析能力和应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子的大小在1nm~1000nm之间 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | 明矾在水中能生成氢氧化铝胶体,故可作净水剂 | |
| D. | 用光束照射CuSO4溶液不能观察到丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
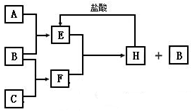 A、B、C是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):
A、B、C是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1CaCl2溶液等体积混合:c(Na+)+2c(Ca2+)═c(CH3COO-)+c(CH3COOH)+c(Cl-) | |
| B. | 浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| C. | pH相同的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)<c(K+)═2c(Ba2+) | |
| D. | 常温下,0.2mol•L-1NH4NO3溶液与0.1mol•L-1NaOH溶液等体积混合,所得pH═9.6的溶液中:c(NO3-)>c(Na+)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将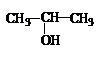 与NaOH的水溶液共热制备CH3-CH═CH2 与NaOH的水溶液共热制备CH3-CH═CH2 | |
| B. | 用甲苯与稀硝酸、稀硫酸的混合酸相混制取TNT | |
| C. | 甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 | |
| D. | 向CH3CH2Br中滴入AgNO3溶液就可以检验溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 不需加热就能发生的反应一定是放热反应 | |
| C. | 反应物总能量高于生成物总能量的反应一定是放热反应 | |
| D. | 破坏反应物中的化学键所吸收的总能量多于形成生成物中化学键所放出的总能量的反应一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
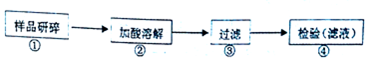
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com