
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1) SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式___________。
(2) SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH为____kJ·mol-1。
(3)对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
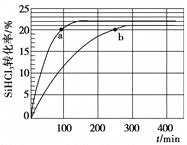
①343 K时,反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是______;要缩短反应达到平衡的时间,可采取的措施有_________。
(4)甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应I(主) :CH3OH(g)+ H2O(g) ![]() CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应II(副) :H2(g)+ CO2(g) ![]() CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应III: CH3OH(g) ![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
反应1能够自发进行的原因是_________,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是________。写出一条能提高CH3OH转化率而降低CO生成率的措施_______。
【答案】2SiHCl3+3H2O=(HSiO)2O+6HCl +114 22 0.02 移走生成物 加入催化剂 该反应为熵增大的反应 升温会促进反应III的发生,提高CO的含量,而CO会破坏该电池的交换膜 加入水蒸气或使用更合适的催化剂
【解析】
(1)SiHCl3遇潮气时发烟生成(HSiO)2O等,说明反应物为SiHCl3、H2O,生成物为(HSiO)2O、HCl,从而写出该反应的化学方程式。
(2)利用盖斯定律进行计算。
(3)假设起始量,再从坐标图象中提取转化率数据,采用三段式进行相关计算。
(4)利用自由能方程分析反应自发进行的原因,再利用题给信息找出升温的缺陷,并找到提高转化率减少CO生成量的措施。
(1)该反应的化学方程式2SiHCl3+3H2O=(HSiO)2O+6HCl;
答案:2SiHCl3+3H2O=(HSiO)2O+6HCl。
(2) 2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·mol-1 ①
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1 ②
将①×3+②得:4SiHCl3(g)=SiH4(g)+3SiCl4(g) ΔH=+114kJ·mol-1;
答案:+114。
(3)因为温度越高,反应速率越快,达平衡的时间越短,所以a为343 K时SiHCl3的转化率曲线,b为323 K时SiHCl3的转化率曲线。
①从图中可以看出,343 K时,反应的平衡转化率α=22%,
设反应物的起始浓度为2mol/L
2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)
SiH2Cl2(g)+SiCl4(g)
起始量 2mol/L 0 0
变化量 0.44mol/L 0.22mol/L 0.22mol/L
平衡量 1.56mol/L 0.22mol/L 0.22mol/L
平衡常数K343 K=![]() ;
;
答案为:22%;0.02。
②在343 K下,要提高SiHCl3转化率,可采取的措施是移走生成物;
要缩短反应达到平衡的时间,可采取的措施有加入催化剂,加快反应速率;
答案为:移走生成物;加入催化剂。
(4)依据自由能方程,G=H-TS,H>0,要使G<0,S>0。反应1能够自发进行的原因是该反应为熵增大的反应;
从题给信息可以看出,升温有利于反应I,有利于反应II,还会促进反应III的发生。即提高CH3OH转化率,但也存在一个明显的缺点是升温会促进反应III的发生,提高CO的含量,而CO会破坏该电池的交换膜。
水蒸气为主反应的反应物,故加入水蒸气可以提高甲醇的转化率,同时使反应II的平衡逆向移动,从而降低了CO的生成率;也可使用更合适的催化剂,最好只催化反应I,不催化反应II,也能达到目的。
所以能提高CH3OH转化率而降低CO生成率的措施为加入水蒸气或加入更合适的催化剂。
答案为:该反应为熵增大的反应;升温会促进反应III的发生,提高CO的含量,而CO会破坏该电池的交换膜;加入水蒸气或使用更合适的催化剂。


科目:高中化学 来源: 题型:
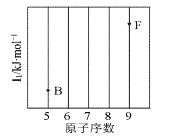
【题目】(1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置_______。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为________。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
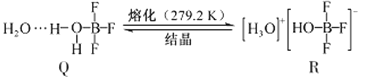
①晶体Q中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(4)已知苯酚(![]() )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法是目前“海水提溴”使用到的主要方法之一。其工艺流程如下:
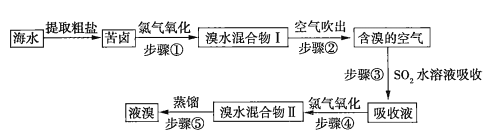
(1)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过___________(填化合物名称)溶液,以除去氯气。
(2)步骤⑤的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因_____________。
(3)步骤①中用硫酸酸化可提高![]() 的利用率,理由是__________。
的利用率,理由是__________。
(4)提取溴单质时,蒸馏溴水混合物Ⅱ而不是蒸馏溴水混合物Ⅰ,请说明原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应为:Li+MnO2=LiMnO2,下列说法正确的是( )
A.锂是正极,电极反应为:Li-e-=Li+B.锂是负极,电极反应为:Li-e-=Li+
C.锂是负极,电极反应为:MnO2+e-=MnO![]() D.锂是负极,电极反应为:Li-2e-=Li2+
D.锂是负极,电极反应为:Li-2e-=Li2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A、C原子的L能层中都有两对未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对的电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号________,该能层具有的原子轨道数为_________。
(2)E2+离子的价层电子排布图是__________,F原子的电子排布式是__________。
(3)A元素的最高价氧化物对应的水化物中心原子采用的轨道杂化方式为______,B元素的气态氢化物的VSEPR模型为___________。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们的结构相似,DAB-的电子式为_____________
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为________________________
(6)某种化合物由D、E、F三种元素组成,其晶胞如图所示,其化学式为_____。
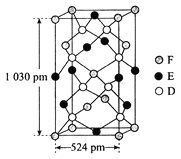
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成医用麻醉药苄佐卡因E和食品防腐剂J的路线如图所示:
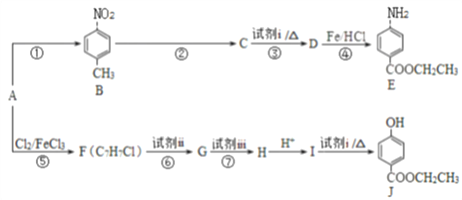
已知:
请回答下列问题:
(1)A属于芳香烃,结构简式为_____________。
(2)E中官能团的名称是氨基、____________。
(3)C能与NaHCO3溶液反应,反应③的化学方程式是___________。
(4)反应⑥、⑦中试剂ii和试剂iii依次是 ___________、___________。
(5)反应①~⑦中,属于取代反应的是_______________。
(6)J有多种同分异构体,其中符合下列条件的同分异构体有______________种,写出其中任一种同分异构体的结构简式:___________。
a. 为苯的二元取代物,其中一个取代基为羟基
b. 属于酯类,且能发生银镜反应
(7)以A为起始原料,选用必要的无机试剂合成高分子树脂(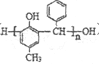 ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_______________。
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣![]() 主要成分为ZnO,还含有铁、铝、铜的氧化物,
主要成分为ZnO,还含有铁、铝、铜的氧化物,![]() 、
、![]() 、
、![]() 等
等![]() 制取氧化锌的工艺流程如图所示:
制取氧化锌的工艺流程如图所示:
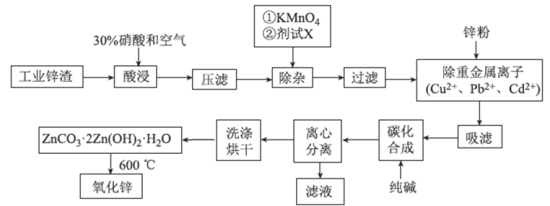
已知:相关金属离子![]() 生成氢氧化物沉淀的pH如下表所示:
生成氢氧化物沉淀的pH如下表所示:
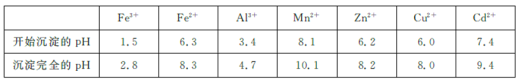
回答下列问题:
![]() 为调节溶液的pH,则试剂X为_________
为调节溶液的pH,则试剂X为_________![]() 填化学式
填化学式![]() ,
,
![]() 除杂时加入高锰酸钾的作用是_________,发生反应的离子方程式为___________。
除杂时加入高锰酸钾的作用是_________,发生反应的离子方程式为___________。
![]() “过滤”所得滤渣的主要成分是_________
“过滤”所得滤渣的主要成分是_________![]() 填化学式
填化学式![]() 。
。
![]() 写出“碳化合成”的化学方程式:________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________。
写出“碳化合成”的化学方程式:________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 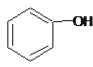 和
和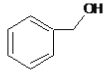 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
B. ![]() 和
和 ![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香族化合物
既是芳香烃又是芳香族化合物
C. 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式一定为C2H5-OH
D. 分子式为C4H8的有机物可能存在4个C—C单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中错误的是
A.溴苯中含有溴单质,可用NaOH溶液洗涤,再经分液而除去
B.除去苯中的少量苯酚:加入NaOH溶液、振荡、静置分层后,除去水层
C.除去乙酸乙酯中少量的乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯
D.用![]() 溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀
溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com