
【题目】硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛。将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3·5H2O(大苏打)。
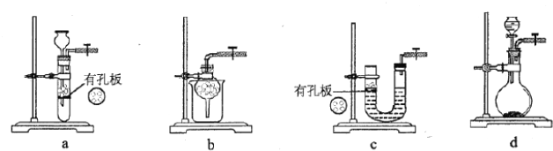
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是________(填标号);检查该装置气密性的操作是:关闭止水夹,再_____________。
(2)向Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为_________________(生成的盐为正盐);
②浅黄色沉淀保持一段时间不变,有无色无味的气体产生,则反应的化学方程式为____________________(生成的盐为正盐);
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为____(生成的盐为酸式盐)。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为____________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是_________________。
【答案】d打开分液漏斗活塞向烧瓶中加水,如果水无法滴入说明气密性良好3SO2+2Na2S===3S↓+2Na2SO3SO2+Na2CO3===Na2SO3+CO2Na2S2O3+SO2+H2O===S↓+2NaHSO32∶1Na2S溶液
【解析】
(1)因为Na2SO3易溶于水,a、b、c装置均不能选用,实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是d;检查该装置气密性的操作是:关闭止水夹,若气密性很好,则分液漏斗中水不能滴入烧瓶中;故答案为:d;打开分液漏斗活塞加水,如水无法滴入说明气密性良好;
(2)①浅黄色沉淀先逐渐增多,其反应原理为SO2+Na2S+H2O=H2S+Na2SO3,2H2S+SO2=3S↓+2H2O,即反应的化学方程式为:3SO2+2Na2S=3S↓+2Na2SO3;故答案为:3SO2+2Na2S=3S↓+2Na2SO3;
②浅黄色沉淀保持一段时间不变,有无色无嗅的气体产生,则反应的化学方程式为,无色无味的气体为CO2气体,其化学方程式为SO2+Na2CO3=Na2SO3+CO2;故答案为:SO2+Na2CO3=Na2SO3+CO2;
④浅黄色沉淀逐渐减少,这时有Na2S2O3生成黄色沉淀,减少的原理为:Na2SO3+S=Na2S2O3,根据题意Na2S2O3能与中强酸反应,继续通入SO2,浅黄色沉淀又会逐渐增多,所以浅黄色沉淀又增多的原理为:Na2S2O3+SO2+H2O=S↓+2NaHSO3;故答案为:Na2S2O3+SO2+H2O=S↓+2NaHSO3;
(3)①3SO2+2Na2S=3S↓+2Na2SO3,②SO2+Na2CO3=Na2SO3+CO2,③Na2SO3+S=Na2S2O3,①+②+③×3得:4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2;所以Na2S和Na2CO3的物质的量之比为2:1;因为SO2先和Na2S反应,所以温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液,Na2S溶液的pH更大;故答案为:2:1;Na2S溶液。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:
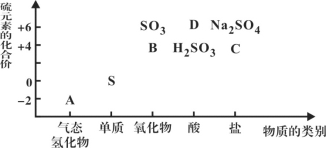
(1)图中A、B、C、D四种物质中,属于非电解质的是__________(用化学式表示)。
(2)足量B通入紫色石蕊试液的现象是______________________________________;
FeCl3溶液(酸性)中通入B的离子方程式为___________________________。
(3)C在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上其可被还原为____(填标号)。
A.Na2S B.S C.H2SO3 D.Na2SO4 E.H2SO4
(4)从硫元素化合价分析,硫单质具有氧化性和还原性。请举一例说明其具有氧化性(用化学方程式表示)_______________________________。
(5)将A与SO2混合,可生成淡黄色固体。该反应的氧化产物与还原产物的质量之比为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
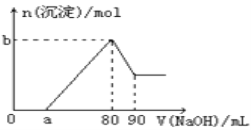
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的键线式为: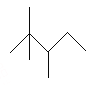 ,有机物B与等物质的量的H2发生加成反应可得到A。
,有机物B与等物质的量的H2发生加成反应可得到A。
下列有关说法错误的是
A. A的最简式为C4H9
B. A的一氯代物有5种
C. A有许多同分异构体,其中主链碳数为5有机物有5种(不包括A)
D. B的结构可能有3种,其中一种名称为:2,2,3—三甲基—3—戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。(已知Co2O3的氧化性>Cl2的氧化性)。从废料中回收氧化钴(CoO)的工艺流程如下:
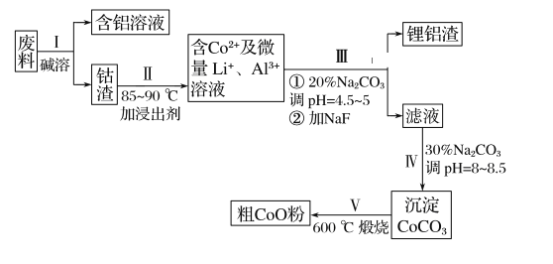
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为__________。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钴物质的反应化学方程式为(产物中只有一种酸根)__________________________________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因:___________________________________________________________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式:__________________________________。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是_____。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是________(填标号)。
A.c(Na+)=2c(CO![]() ) B.c(Na+)>c(CO
) B.c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )
)
C.c(OH-)>c(HCO![]() )>c(H+) D.c(OH-)-c(H+)=c(HCO
)>c(H+) D.c(OH-)-c(H+)=c(HCO![]() )+2c(H2CO3)
)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请认真阅读下列三个反应:
①
②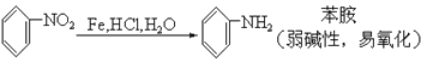
③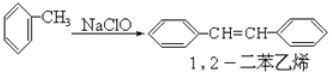
利用这些反应,按以下步骤可从某烃A合成一种染料中间体DSD 酸。(试剂和条件已略去)
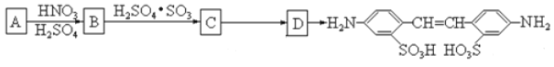
请写出A、B、C、D的结构简式。
A_______________;B_______________;C_______________;D_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃烧 D. 碳酸盐的沉积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某CuSO4、Fe2(SO4)3、H2SO4 的混合溶液 100mL, 已知溶液中阳离子的浓度相同,且 SO42-的物质的量浓度为6 mol L-1,则此溶液最多溶解铁粉的质量为( )
A. 5.6 g B. 11. 2 g C. 22.4 g D. 33. 6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学们在实验室里用不同的方法分别制取Cu(NO3)2,并在此基础上探究Cu(NO3)2的化学性质。
(1)甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2,反应的化学方程式是___。
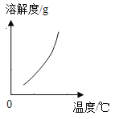
(2)乙组同学查阅了硝酸铜晶体的溶解度曲线(下图),据此设计了以下实验方案,先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、____________、过滤、洗涤、干燥。乙组同学认为此方案优于甲组的方案,理由之一是_____。
(3)丙组同学用Cu(NO3)2晶体,探究其热稳定性,实验装置如下所示。(夹持装置和加热仪器未画出)

①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,红棕色气体是____________。
②集气瓶中最终收集到的气体颜色是____________,U形管中进入集气瓶后颜色发生变化的原因是___。
③欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解],实验方案是___。
④由该实验可得出的结论是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com