
| A、+6 | B、+3 | C、+2 | D、0 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
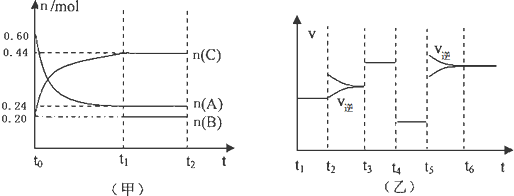
| A、若t1=15s,则t0-t1阶段以A浓度变化表示的反应速率v(A)为0.006mol/(L?s) |
| B、B的起始物质的量为0.08mol |
| C、若t2-t3阶段改变的条件是增大A的浓度,则平衡时C的体积分数变大 |
| D、该反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=2c( HS-)+2c(S2-)+2c(H2S) |
| B、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C、c(Na+)>c(S2-)>c(OH-)>c(HS-) |
| D、c(OH-)=c(HS-)+c(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、锂离子电池与传统铅蓄电池相比,具有高比能量(比能量指的是单位重量或单位体积的能量)的特点 |
| B、废旧锂离子电池先进行“放电处理”让Li+进入石墨(C6)中而利于回收 |
| C、放电时,正极锂的化合价未发生改变 |
| D、充电时电池正极上发生的反应为:LiCoO2-x e-═Li1-x CoO2+xLi+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、C(石墨)+
| ||
| B、C(石墨)+O2(g)═CO(g);△H=-111.1kJ?mol-1 | ||
| C、C(石墨)+O2(g)═CO2(g);△H=-394kJ?mol-1 | ||
| D、C(石墨)+O2(g)═CO2(g);△H=-28.3kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知2C(s)+2O2(g)═2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 | |||
B、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol | |||
| D、已知2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O |
| B、碳酸氢钠溶液中加稀硫酸:CO32-+2H+=H2O+CO2↑ |
| C、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、Cu(OH)2加入H2SO4:2H++Cu(OH)2=Cu2++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com