
| A、稀盐酸 | B、稀硫酸 |
| C、氢氧化钠溶液 | D、氨水 |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
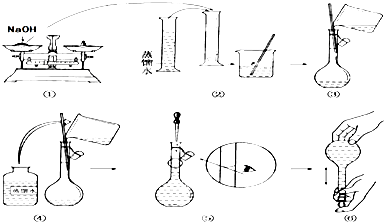
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
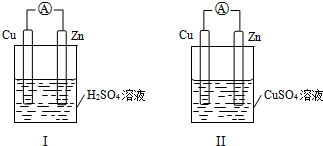
| A、装置Ⅰ,铜片上有O2逸出 |
| B、装置Ⅰ,锌片溶解,发生还原反应 |
| C、装置Ⅱ,电池反应为:Zn+Cu2+=Zn2++Cu |
| D、装置Ⅱ,外电路中,电子从铜电极流向锌电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
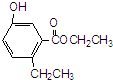
| A、R在碱性条件下的水解产物难溶于水 |
| B、R分子中有7种化学环境均不同的氢原子 |
| C、R和溴水反应后所得产物的化学式为C11H12O3Br2 |
| D、R不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- |
| B、0.1mol?L-1FeCl3溶液中大量存在Fe2+、NH4+、SCN-、SO42- |
| C、0.1mol?L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| D、中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、3:1 |
| C、2:5 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在该反应中维生素C作催化剂 |
| B、砒霜是砷的氧化物,由上述信息可推知砒霜中含有的砷可能是+3价砷 |
| C、因为河虾中含有砷元素,所以不能食用 |
| D、上述反应中维生素C作氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com