
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
分析 ①A、B两溶液呈碱性,结合离子的共存可知,应为Ba(OH)2、Na2CO3中的一种,C、D、E溶液呈酸性,应为AgNO3、Al2(SO4)3、HCl中的一种;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生,则A为Na2CO3,B为Ba(OH)2,E为Al2(SO4)3,C为HCl;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀,则D为AgNO3,然后结合物质的性质及化学用语来解答.
解答 解:(1)由以上分析可知A为Na2CO3,B为Ba(OH)2,C为HCl,D为AgNO3,E为Al2(SO4)3,故答案为:Ba(OH)2;AgNO3;
(2)A、E发生相互促进水解反应,离子反应为2Al3++3CO32-+3H2O═3CO2↑+2Al(OH)3↓,故答案为:2Al3++3CO32-+3H2O═3CO2↑+2Al(OH)3↓;
(3)A为Na2CO3,碳酸根离子水解显碱性,第一步水解大于第二步水解,则离子浓度大小为[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+],故答案为:[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+];
(4)B为Ba(OH)2,C为HCl,又NaOH( aq)+HNO3(aq)=NaNO3( aq)+H20(1)△H=-Q kJ•mol-l,则B与C的稀溶液反应的热化学方程式为OH-(aq)+H+(aq)=H2O(1)△H=-QkJ/mol或$\frac{1}{2}$Ba(OH)2(aq)+HC1(aq)=$\frac{1}{2}$BaC12(aq)+H2O(1)△H=-Q kJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2QkJ/mol,
故答案为:OH-(aq)+H+(aq)=H2O(1)△H=-QkJ/mol或$\frac{1}{2}$Ba(OH)2(aq)+HC1(aq)=$\frac{1}{2}$BaC12(aq)+H2O(1)△H=-Q kJ/mol或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2QkJ/mol,;
(5)E为Al2(SO4)3,硫酸铝和氢氧化钠的反应实质为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=[Al(OH)4]-,
100mL 0.1mol/L的硫酸铝溶液中,含有铝离子的物质的量为0.02mol,
40mL 1.6mol/L NaOH溶液中含有氢氧化钠物质的量为0.064mol,
Al3++3OH-=Al(OH)3↓,
0.02mol 0.06mol 0.02mol
0.02mol铝离子消耗0.06mol的氢氧化钠生成0.02mol的氢氧化铝,
Al(OH)3+OH-=[Al(OH)4]-,
0.004mol 0.004mol
然后多余0.004mol的氢氧化钠又将0.004mol的氢氧化铝溶解,
所以剩余氢氧化铝的物质的量是0.02mol-0.004mol=0.016mol,
故答案为:0.016.
点评 本题考查知识点较多,侧重于学生的分析能力和计算能力的考查,根据离子的共存、离子的性质来推断物质是解答本题的关键,综合性强,难度较大,学生需熟悉水解、热化学反应方程式、离子反应等知识来解答.


科目:高中化学 来源: 题型:选择题
| A. | 环氧乙烷的结构简式:C2H4O | B. | 中子数为16的磷原子:${\;}_{15}^{16}$P | ||
| C. | 氯原子的结构示意图: | D. | PC13的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
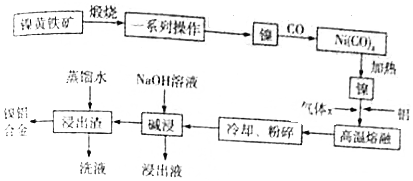
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
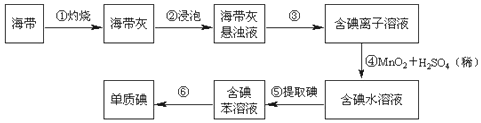
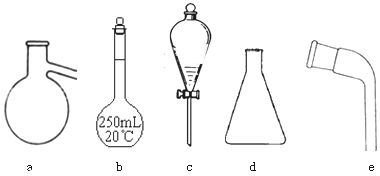
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20 mol•L-1 | B. | 0.25 mol•L-1 | C. | 0.225 mol•L-1 | D. | 0.45 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 室温下,向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) | |
| D. | 25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合:c(CH3COOH)+c(CH3COO-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 已知C(s)+O2(g)═CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)=CO(g)△H2;则△H2>△H1 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| D. | 放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com