
对于可逆反应2SO2+O22SO3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强 B.升高温度
C.使用催化剂 D.多充O2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
日常所用干电池的电极分别为碳棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应式可简化为:
Zn-2e-—→Zn2+,2NH +2e-—→2NH3↑+H2↑(NH3与Zn2+能生成一种稳定的物质)。根据上述判断,下列结论不正确的是( )
+2e-—→2NH3↑+H2↑(NH3与Zn2+能生成一种稳定的物质)。根据上述判断,下列结论不正确的是( )
A.Zn为正极,碳为负极
B.Zn为负极,碳为正极
C.工作时,电子由Zn极经过导线流向碳极
D.长时间连续使用时,内装糊状物可能流出腐蚀用电器
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是 ( )
A.当两种原子的电负性相差很大时,相互之间通常形成离子键
B.不含金属元素的化合物不一定是共价化合物
C.HCl分子中的共价键是由氢原子的1s轨道和氯原子的3s轨道重叠形成的
D.四氯化碳分子中含四个共价单键,为正四面体
查看答案和解析>>
科目:高中化学 来源: 题型:
在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为 ( )
A.1 mol·L-1 B.2.5 mol·L-1
C.5 mol·L-1 D.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于原子结构、元素性质的说法正确的是( )
A.非金属元素组成的化合物中只含共价键
B.ⅠA族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
自然界的矿物、岩石的形成和变化受到许多条件的影响。地壳内每加深1 km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:
SiO2(s)+4HF(g)SiF4(g)+2H2O(g)
ΔH=-148.9 kJ·mol-1
如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,下列说法不正确的是( )
A.2v正(HF)=v逆(H2O)
B.v正(H2O)=2v逆(SiF4)
C.SiO2的质量保持不变
D.容器内压强不变
查看答案和解析>>
科目:高中化学 来源: 题型:
利用反应2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应A+B—→C,如果温度每升高10 ℃,反应速率增加为原来的3倍。在10 ℃时,完成反应的20%需要54 min;将温度提高到40 ℃,完成反应的20%需要的时间为( )
A.2 min B.3 min
C.6 min D.9 min
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.石灰乳与Na2CO3溶液混合:Ca2++CO ===CaCO3↓
===CaCO3↓
B.NH4HSO3溶液与足量的NaOH溶液混合加热:
NH +HSO
+HSO +2OH-
+2OH-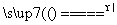 NH3↑+SO
NH3↑+SO +2H2O
+2H2O
C.酸性条件下KIO3溶液与KI溶液反应生成I2:IO +5I-+3H2O===3I2+6OH-
+5I-+3H2O===3I2+6OH-
D.AgNO3溶液中加入过量氨水:Ag++NH3·H2O===AgOH↓+NH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com