
分析 (1)元素甲是第3周期ⅦA族元素,则甲为Cl,甲元素与另两种非金属元素可组成离子化合物A,应是铵盐,即A为氯化铵,含有离子键与共价键;
(2)在第3周期元素的气态氢化物中,元素乙的氢化物最稳定,乙应为Cl元素;
(3)金属元素丙形成的某化合物的溶液常用于检验CO2,则丙为Ca,电子层结构相同的离子,核电荷数越大离子半径越小;
(4)元素丁的原子序数比丙小8,则丁为Mg,Mg在CO2中燃烧生成MgO与碳.
解答 解:(1)元素甲是第3周期ⅦA族元素,则甲为Cl,甲元素与另两种非金属元素可组成离子化合物A,应是铵盐,即A为NH4Cl,含有离子键与共价键,
故答案为:NH4Cl;离子键、共价键;
(2)在第3周期元素的气态氢化物中,元素乙的氢化物最稳定,乙应为Cl元素,氯气和氢氧化钠反应的化学方程式为Cl2+NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+NaOH=NaCl+NaClO+H2O;
(3)金属元素丙形成的某化合物的溶液常用于检验CO2,则丙为Ca,电子层结构相同的离子,核电荷数越大离子半径越小,离子半径:r(Cl-)>r(Ca2+),
故答案为:r(Cl-)>r(Ca2+);
(4)元素丁的原子序数比丙小8,则丁为Mg,Mg在CO2中燃烧生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,明确元素周期律内容、元素周期表结构为解答关键,试题知识点较多、综合性较强,充分开心学生的分析、理解能力及灵活应用能力.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 卤素单质与水反应的通式为X2+H2O?HX+HXO | |
| B. | HX都极易溶于水,它们的热稳定性随核电荷数增大而增强 | |
| C. | 卤素单质的颜色随相对分子质量增大的顺序而加深 | |
| D. | X-离子的还原性依次为:F-<Cl-<Br-<I-,因此相对分子质量小的卤素单质可将相对分子质量大的卤素从它的盐溶液里置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Na2O2固体投入滴加了少许酚酞的蒸馏水中,溶液先变红后褪色 | |
| B. | 用玻璃棒蘸取浓硝酸滴加到pH试纸上,试纸先变红后变成白色 | |
| C. | 向胆矾晶体(CuSO4•5H2O)滴加浓硫酸,晶体由蓝色变为黑色 | |
| D. | 将SO2通入品红溶液中,溶液颜色褪去,加热后又变成红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
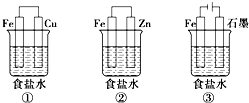 铁、铝及其化合物在生产和生活中有着广泛的应用.某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是①(填装置序号),该装置中正极反应式为O2+2H2O+4e-=4OH-;为防止金属Fe被腐蚀,可以采牺牲阳极的阴极保护法的是上述②(填装置序号)装置原理进行防护;装置②的负极反应的电极反应式Zn-2e-=Zn2+;装置③中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.
铁、铝及其化合物在生产和生活中有着广泛的应用.某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是①(填装置序号),该装置中正极反应式为O2+2H2O+4e-=4OH-;为防止金属Fe被腐蚀,可以采牺牲阳极的阴极保护法的是上述②(填装置序号)装置原理进行防护;装置②的负极反应的电极反应式Zn-2e-=Zn2+;装置③中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,是最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
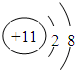 ;
;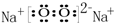 .写出该物质的一种用途作供氧剂
.写出该物质的一种用途作供氧剂查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 医疗上使用75%的酒精用于消毒 | |
| D. | 糖类、油脂、蛋白质在一定条件下都可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH | |
| B. | 向10mL 0.1 mol/L的AgNO3溶液中滴加10滴0.1 mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1 mol/L的KI溶液,沉淀变为黄色,说明相同温度下AgCl溶解度大于AgI的溶解度 | |
| C. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀,说明Y中不含醛基 | |
| D. | 取少量卤代烃Y在碱性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黄色沉淀,说明卤代烃中含有溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醚作燃料会产生氮的氧化物和碳氢化合物等污染物 | |
| B. | 甲醚可由甲醇在一定条件下发生消去反应而制得 | |
| C. | 甲醚与乙醇是同分异构体 | |
| D. | 1 mol甲醚完全燃烧消耗的氧气与1 mol甲醇完全燃烧消耗的氧气相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴阳离子间通过静电吸引形成的化学键叫做离子键 | |
| B. | HF,HCl,HBr,HI的热稳定性和酸性均依次减弱 | |
| C. | 元素非金属越强,其对应含氧酸的酸性就越强 | |
| D. | 元素周期律是元素原子核电子排布周期性变化的结果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com