
| A. | 氯水 | B. | 氢硫酸 | C. | 烧碱 | D. | 绿矾 |
分析 强电解质是指在水溶液中或熔融状态下能完全电离的化合物,根据题干的要求来分析.
解答 解:A、氯水是混合物,故不是电解质也不是非电解质,故A错误;
B、H2S在熔融状态下不能电离,在水溶液中只能部分电离,故为弱电解质,故B错误;
C、烧碱即NaOH,在水溶液中和熔融状态下均能完全电离,故为强电解质,但在空气中久置后变为碳酸钠,颜色不变,故C错误;
D、绿钒为FeSO4•7H2O,在水溶液中和熔融状态下均可以完全电离,故为强电解质,在空气中久置后被空气氧化为Fe2(SO4)3,颜色发生改变,故D正确.
故选D.
点评 本题考查了强弱电解质的判断和物质在空气中久置的变化,应注意的是物质在空气中久置可能与空气中的水、二氧化碳反应,也可能是被氧气氧化.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 热化学方程式中,化学式前面的化学计量数只能表示物质的量 | |
| B. | 1 moL H2生成1 mol H20时放出的热量就是氢气的燃烧热的值 | |
| C. | 用1mol/L的硫酸和适量的稀的Ba(OH)2溶液反应可以测量中和热的值 | |
| D. | 条件相同,用16g固体硫或32 g固体硫分别在02中充分燃烧,测定的硫的燃烧热不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量AlO2-的溶液中:Na+、K+、HCO3-、NO3- | |
| B. | 中性溶液中:K+、Cl-、SO42-、Al3+ | |
| C. | 加Al粉产生H2溶液中:SO42-、K+、Cu2+、Cl- | |
| D. | pH=1的溶液中:NH4+、Na+、Fe3+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃,0.1mol/L pH=4.5 的NaHC2O4溶液 c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| B. | 向0.2mol/L的NaHCO3溶液中加入等体积的0.1mol/L的NaOH溶液c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) | |
| C. | 常温下,氯化铵和氨水的混合溶液其pH=7,c(Cl-)=0.1mol/L c(Cl-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 浓度均为0.1mol/L的醋酸钠和醋酸的混合溶液中c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| B. | CH≡CH$→_{催化剂△}^{HCl}$CH2=CHCl$→_{△}^{催化剂}$ | |
| C. | HCHO$\stackrel{O_{2}}{→}$HCOOH$→_{NaOH}^{CH_{2}OH}$HCOOCH3 | |
| D. | CH2═CH2$→_{催化剂△}^{O_{2}}$CH3CHO$→_{△}^{银氨溶液}$CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、Cl-、NO3- | B. | Fe3+、Ba2+、Cl-、I- | ||
| C. | Na+、NH4+、SO42-、OH- | D. | K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
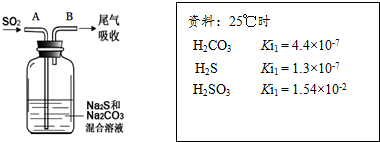
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应一定有单质参与 | |
| B. | 氧化还原反应的实质是电子转移 | |
| C. | 有元素化合价升降的反应一定是氧化还原反应 | |
| D. | 氧化剂在反应中化合价降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com