
| A. | 元素Y的最高正化合价为+6 | B. | 离子半径的大小顺序为W>Q>Z>X>Y | ||
| C. | 工业上用电解法冶炼Z单质 | D. | 元素Q的含氧酸的酸性一定比W的强 |
分析 短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,则Y的氢化物作溶剂,且为氢化物,则Y的氢化物是H2O,所以Y是O元素;X的氢化物能溶于水,且X的原子序数小于Y,所以X是N元素;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,铝、铁能溶于稀硫酸却不溶于浓硫酸,Z是短周期主族元素,所以Z是Al、W是S元素;Q属于短周期主族元素且原子序数大于S,所以Q是Cl元素,据此结合元素周期律来分析解答.
解答 解:短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,则Y的氢化物作溶剂,且为氢化物,则Y的氢化物是H2O,所以Y是O元素,X的氢化物能溶于水,且X的原子序数小于Y,所以X是N元素;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,铝、铁能溶于稀硫酸却不溶于浓硫酸,Z是短周期主族元素,所以Z是Al,W是S元素,Q属于短周期主族元素且原子序数大于S,所以Q是Cl元素,
A.Y是O元素,O元素没有正化合价,故A错误;
B.电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小,X、Y、Z离子的电子层结构相同,且原子序数Z>Y>X,所以离子半径X>Y>Z,W、Q离子的电子层结构相同,且W的原子序数小于Q,所以离子半径W>Q,W、Q离子的电子层数大于X、Y、Z,则离子半径大小顺序是W>Q>X>Y>Z,故B错误;
C.Z为Al,铝为活泼金属,工业上通过电解熔融氧化铝获得铝,故C正确;
D.W为S、Q为Cl元素,Cl的含氧酸的酸性不一定比S的强,如次氯酸的酸性小于硫酸,故D错误;
故选C.
点评 本题考查了原子结构和元素周期律的关系,题目难度中等,正确推断元素是解本题关键,结合元素周期律来分析解答即可,注意离子半径大小的比较方法,为易错点,试题培养了学生的分析能力及灵活应用基础知识的能力.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ④②①③⑤ | C. | ②①③④⑤ | D. | ④②③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
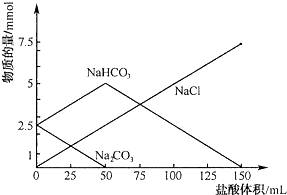
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中位于金属与非金属分界线附近的元素属于过渡元素 | |
| B. | 水是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| D. | 离子化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO3所含的氧原子数为1.5NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| D. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
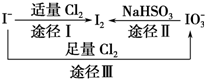 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系,根据图示转化关系推测下列说法不正确的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系,根据图示转化关系推测下列说法不正确的是( )| A. | 可用KI-淀粉试纸和食醋检验加碘盐中是否含有碘 | |
| B. | 足量Cl2能使湿润的KI-淀粉试纸变白的原因可能是:5Cl2+I2+6H2O═2HIO3+10HCl | |
| C. | 由图可知氧化性的强弱顺序为Cl2>I2>IO${\;}_{3}^{-}$ | |
| D. | 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com