
| A. | N2O5的平衡浓度为3.0mol•L-1 | B. | N2O5的转化率为80% | ||
| C. | N2O的平衡浓度为4.4mol•L-1 | D. | N2O的平衡浓度为1.4mol•L-1 |
分析 根据N原子守恒:c平衡(N2O5)+c平衡(N2O3)+c平衡(N2O)=c起始(N2O5),根据O原子守恒:5c平衡(N2O5)+3c平衡(N2O3)+c平衡(N2O)+2c平衡(O2)=5c起始(N2O5),联立方程计算平衡时N2O5、N2O的平衡浓度,N2O5的转化率=$\frac{{N}_{2}{O}_{5}浓度变化量}{{N}_{2}{O}_{5}起始浓度}$×100%.
解答 解:N2O5的起始浓度为$\frac{2.5mol}{0.5L}$=5mol/L,
根据N原子守恒:c平衡(N2O5)+c平衡(N2O3)+c平衡(N2O)=c起始(N2O5),即:
c平衡(N2O5)+1.6mol/L+c平衡(N2O)=5mol/L,
根据O原子守恒:5c平衡(N2O5)+3c平衡(N2O3)+c平衡(N2O)+2c平衡(O2)=5c起始(N2O5),即:
5c平衡(N2O5)+3×1.6mol/L+c平衡(N2O)+2×4.4mol/L=5×5mol/L,
联立方程解得:c平衡(N2O5)=2mol/L,c平衡(N2O)=1.4mol/L,
N2O5的转化率为$\frac{5mol/L-2mol/L}{5mol/L}$×100%=60%,
由上述分析可知,ABC错误,D正确,
故选:D.
点评 本题考查化学平衡的有关计算,题目利用原子守恒进行计算解答,侧重考查学生分析计算能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
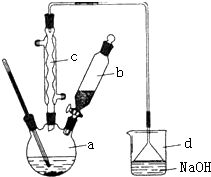 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr;
+HBr;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (Ⅰ)一研究性学习小组对某工业城市的空气污染进行了下列研究.
(Ⅰ)一研究性学习小组对某工业城市的空气污染进行了下列研究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 | 除去氯化钠晶体中混有的氯化铵晶体 | 分离CCl4中的I2 | 分离酒精和水 | 除去CO气体中的CO2气体 |
| 装置 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com