
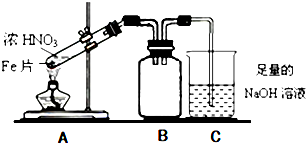
分析 (1)Fe与Cl2反应生成FeCl3,Cu与Cl2反应生成CuCl2,Fe与S反应生成FeS;
(2)Fe能和热的浓HNO3反应生成二氧化氮,二氧化氮能和水反应,若A与C直接连接,C中液体能倒吸到A中,所以装置B具有缓冲作用、防倒吸作用,开始加热前无明显现象;
(3)①根据二氧化氮的性质分析,二氧化氮能和水反应生成硝酸,当溶液中硝酸过量时,二氧化氮会剩余,气体呈红棕色;硝酸过量时,铁和硝酸反应生成三价铁,根据三价铁的性质分析;
②先根据Fe3+的特征反应,加入硫氰酸钾溶液判断溶液不含Fe3+,然后加入氧化剂,如果含有Fe2+,Fe2+被氧化剂氧化成Fe3+溶液变成红色,以此证明Fe2+的存在;
③根据N原子守恒可知,溶液中NO3-的物质的量n(NO3-)=2n(Fe2+)+2n(Cu2+),硝酸只被还原成NO和NO2共0.02mol,根据得失电子守恒计算生成NO的物质的量;
(4)浓硝酸易挥发、易分解.
解答 解:(1)氯气具有强氧化性,与铁、铜等金属反应时生成高价金属氯化物,例如FeCl3、CuCl2,而硫的氧化性较差,只能得到FeS、Cu2S,故选B;
(2)铁在常温下与浓硫酸钝化,无明显现象;加热后,硝酸可被铁还原,得到NO2或NO气体,气体被碱液吸收,为防止倒吸,采用了B装置来做安全瓶,故答案为:缓冲作用、防倒吸作用;无;
(3)①二氧化氮能和水反应生成硝酸和一氧化氮,当溶液中硝酸过量时,抑制二氧化氮的溶解,所以Cu片溶解的原因可能是和过量的HNO3发生反应,可看到生成无色气体,试管上部出现红棕色气体,该反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,硝酸过量时,铁和硝酸反应生成三价铁,三价铁和铜能反应生成二价铁离子和铜离子,从而使铜片溶解,发生反应为2Fe(NO3)3+Cu=Cu(NO3)2+2Fe(NO3)2,
故答案为:生成无色气体、试管上部出现红棕色气体;3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;2Fe(NO3)3+Cu=Cu(NO3)2+2Fe(NO3)2;
②取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+,
故答案为:取该溶液少许,滴加适量的KSCN溶液,不出现红色,再滴加适量新制氯水,出现红色;
③由溶质Fe(NO3)2及Cu(NO3)2的化学式可看出,两者所对应的c(NO3-)均为0.04mol/L,故溶液中c(NO3-)均为0.08mol/L,
设NO与NO2的物质的量分别为x、y,则x+y=0.02;
铁铜单质均转化为+2价的金属离子,失电子总数为0.04mol,故由电子的得失守恒得3x+y=0.04
解得x=y=0.01mol,故在标准状况下NO的体积为0.224升,
故答案为:0.08;0.224;
(4)实际消耗硝酸的物质的量为$\frac{3×1.5×95%}{63}$=0.68mol,而由氮元素的守恒可知,理论上消耗的硝酸为0.02+0.02+0.02=0.06mol,导致两数据有差别的原因可能是:①浓硝酸易挥发②硝酸受热分解,
故答案为:①浓硝酸易挥发部分硝酸挥发;②硝酸受热分解.
点评 本题考查物质性质实验方案设计,为高频考点,涉及Cu和Fe及硝酸的性质、实验基本操作、氧化还原反应的计算,侧重考查分析计算能力,知道常见离子检验方法,注意化学用语的正确运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中由水电离出来的c(OH-)=1×10-9mol/L | |
| B. | c(OH-)-c(HY)=c(H+)=1×10-5mol/L | |
| C. | 混合溶液中c(Na+)=c(Y-)+c(HY)=0.15mol/L | |
| D. | 混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某密闭容器中加入0.5molN2和1.5molH2,充分反应后容器中物质含有的N-H键数为3NA | |
| B. | 标准状况下,2.24LSO3含有的原子数为0.4 NA | |
| C. | 71g氯气与足量铁反应过程中转移的电子数为2NA | |
| D. | 电解饱和食盐水时,当阴极产生22.4LH2时,电路中转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
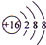
 2NH3,向X的水溶液中滴入酚酞溶液,会观察到溶液变红色
2NH3,向X的水溶液中滴入酚酞溶液,会观察到溶液变红色查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟元素的非金属性最强,所以氢氟酸的酸性最强 | |
| B. | 元素的金属性越强,其最外层电子数就越少 | |
| C. | 在天然元素中,都含有同位素 | |
| D. | 某元素的原子及其阴离子的核外电子层数等于该元素所在的周期数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L | B. | 3.36L | C. | 1.12L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;壬的结构简式
;壬的结构简式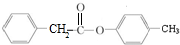


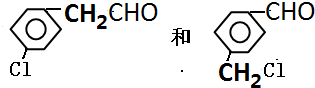 (任写一种)
(任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入Na0H溶液并加热,鉴别地沟油(餐饮废弃油)和矿物油(汽油、煤油等) | |
| B. | 为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 | |
| C. | 为探究温度对化学反应速率的影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| D. | 往含有FeBr2和FeI2的混合溶液中通足量的氯气,然后把溶液蒸干、灼烧,得到FeCl3固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com