
| A. | 酸性溶液中只存在H+,不存在0H-,只有中性溶液或纯水中既有H+又有OH- | |
| B. | 温度越高,KW越大,所以温度高的溶液中的c(H+)一定比温度低的溶液中的c(H+)大 | |
| C. | 水的电离平衡受酸、碱和温度等条件的影响 | |
| D. | 向水中加人碱时,由于加人的OH-与水电离产生的H+作用.使c(H+)减小,平衡向电离的方向移动. |
分析 A、在水溶液中,既存在H+,又存在0H-;
B、Kw=c(H+)•c(0H-);
C、水的电离吸热,电离方程式为:H2O?H++0H-;
D、水的电离方程式为:H2O?H++0H-.
解答 解:A、由于水能电离出氢离子和氢氧根,故只要是在水溶液中,无论是酸性溶液还是中性或是碱性溶液中,均既存在H+,又存在0H-,故A错误;
B、温度越高,Kw越大,但由于Kw=c(H+)•c(0H-),故Kw值越大,c(H+)的值不一定越高,故B错误;
C、水的电离吸热,故升高温度,平衡右移;电离方程式为:H2O?H++0H-,故酸和碱均能抑制水的电离,故C正确;
D、水的电离方程式为:H2O?H++0H-,故加入碱,使c(0H-)增大,则水的电离平衡左移,故D错误.
故选C.
点评 本题考查了影响水的电离平衡的因素,难度不大,应注意的是温度越高,Kw越大,但c(H+)的值不一定越大.


科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | Na2CO3可与盐酸反应 | 碳酸钠溶液可用于治疗胃酸过多 | Ⅰ对,Ⅱ对,有 |
| B | Cl2使鲜艳的红色花瓣褪色 | Cl2具有漂白性 | Ⅰ对,Ⅱ对,有 |
| C | 铝制饮具最好不要盛放酸性或碱性 较强的液体食物 | 因为Al和Al2O3既可以与酸反应, 又可以与碱反应 | Ⅰ对,Ⅱ对,无 |
| D | Na2O2能和CO2、H2O反应生成O2 | 过氧化钠可用作航天员的供氧剂 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
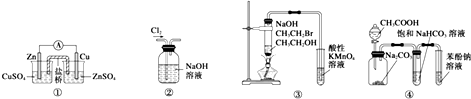
| A. | 装置①:构成锌-铜原电池 | |
| B. | 装置②:除去Cl2中含有的少量HCl | |
| C. | 装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH | |
| D. | 装置③:验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应生成NaOH和H2,推测:所有金属与水反应都生成碱和H2 | |
| B. | 由CO2+Ca(ClO)2+H2O═CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O═CaSO3↓+2HClO | |
| C. | 铝和硫直接化合能得到Al2S3,推测:铁和硫直接化合也能得到 Fe2S3 | |
| D. | 由Na2CO3+2HCl═2NaCl+H2O+CO2↑,推测:Na2SO3+2HCl═2NaCl+H2O+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中H+、NH4+、NO3-、Cl-可以大量共存 | |
| B. | Cu(NH3)4SO4中呈正四面体的原子团只有SO42- | |
| C. | 滴加Na2CO3溶液产生CuCO3蓝色沉淀 | |
| D. | 硫酸铜溶液与氨水作用后可缓缓加入乙醇可产生晶体,其产生晶体的主要原理是CuSO4+4NH3═[Cu(NH3)4]SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
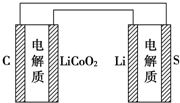 已知电池的比能量是参与电极反应的单位质量的电极材料放出电能的大小.有关下述两种电池说法正确的是( )
已知电池的比能量是参与电极反应的单位质量的电极材料放出电能的大小.有关下述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂硫电池充电时,锂电极发生还原反应 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 如图表示用锂离子电池给锂硫电池充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极反应为Zn-2e-═Zn2+ | |
| B. | 电池总反应为Zn+Cu2+═Zn2++Cu | |
| C. | 取出盐桥,电流表指针仍然偏转 | |
| D. | 盐桥(填充KCl饱和溶液侵泡的琼脂)中的K+移向ZnSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com