
【题目】既可以用来鉴别乙烯和甲烷,又可用来除去甲烷中混有的乙烯的方法是
A.通入足量溴水中B.与酸性高锰酸钾溶液反应
C.在导管中处点燃D.一定条件下与H2反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴[Co(NH3)6]Cl3是一种重要的化工产品,实验室通常是在NH3和NH4Cl存在条件下,以活性炭为催化剂,用H2O2氧化CoC12溶液来制备[Co(NH3)6]Cl3,该反应属于大量放热的反应。某小组用如图所示装置制备[Co(NH3)6]Cl3,实验步骤如下:
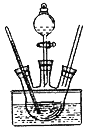
Ⅰ.称取研细的CoC12·6H2O粉末10.0g和NH4Cl5.0g于烧杯中并加水溶解,将溶液转入三颈烧瓶,加入25mL浓氨水和适量活性炭粉末,逐滴加入5mL30%的H2O2溶液。
Ⅱ.用水浴将混合物加热至60℃,恒温20分钟,然后用冰水浴冷却,充分结晶后过滤。
Ⅲ.将沉淀溶于热的盐酸中,趁热过滤,滤液中加适量浓盐酸并冷却结晶。
Ⅳ.过滤、用乙醇洗涤晶体并在105℃条件下烘干。
试回答下列问题:
(1)制备[Co(NH3)6]Cl3的化学方程式是_______________________。
(2)请指出装置中存在的一处缺陷____________________。
(3)若将5mL30%的H2O2溶液一次性加入三颈烧瓶,会出现的问题是_______________。
(4)若无活性炭作催化剂,所得产物中除[Co(NH3)6]Cl3外还会有大量二氯化一氯五氨合钴[Co(NH3)5Cl]Cl2和三氯化五氨一水合钴[Co(NH3)5H2O]Cl3晶体,而在活性炭的催化作用下,主要产物只有[Co(NH3)6]Cl3,这体现了催化剂的________性。
(5)步骤Ⅲ中趁热过滤的主要目的是_____________,滤液中加适量浓盐酸的主要目的是_________。
(6)乙醇洗涤与蒸馏水洗涤相比优点是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝表面在空气中天然形成的氧化膜耐磨性和抗蚀性不够强。控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬致密,耐腐蚀的氧化膜。下列有关叙述正确的是
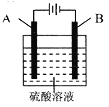
A. 阴极上有金属铝生成
B. 电极A为石墨,电极B为金属铝
C. OH-在电极A上放电,有氧气生成
D. 阳极的电极反应式为:2Al-6e-+3H2O═AL2O3+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下图为实验室蒸馏自来水得到少量蒸馏水的装置示意图,请根据图示回答下列问题:
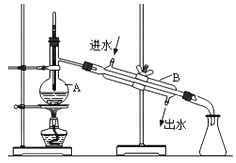
(1)装置中仪器A的名称是___________,仪器B 的名称是_____________。
(2)请指出上图中的三处明显错误中的两处:__________、__________。
Ⅱ.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.蒸馏 B.过滤 C.结晶 D.分液
(1)分离水和煤油的混合物__________。
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾__________。
(3)从加热氯酸钾制氧气后的剩余固体中获得MnO2。溶解、__________。
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 四种元素核电荷数均小于 18。B 元素 L 层两种能量不同的电子个数比为1:2,A、C 元素的原子最外层电子数相等,C、D元素原子电子层数相同。A原子最外层电子数等于电子层数,C 原子最外层电子数是 K 层上电子数的一半。D-离子电子层结构与氩原子电子层结构相同。
(1)四种元素为:A_____B_____C_____D_____
(2)A 离子的结构示意图为_____
(3)B 原子的轨道表示式为_____,C 原子有_____种不同运动状态的电子
(4)D 离子的最外层电子排布式为_____
(5)D 单质与 A2B 反应的化学方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷和乙炔的混合气体20 mL,完全燃烧需45 mL氧气(同温同压下),则此混合气体中甲烷和乙炔的体积比是( )
A.1∶1B.2∶1C.3∶1D.4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有4种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:Ba2+、H+、Na+、NH![]() 、CO
、CO![]() 、NO
、NO![]() 、OH-、SO
、OH-、SO![]() ,将这4种溶液分别标记为A、B、C、D并进行如下实验:
,将这4种溶液分别标记为A、B、C、D并进行如下实验:
①在A或D中滴入C,均有沉淀生成;②A和B反应生成的气体能被D吸收;
③A和D反应生成的气体能被B吸收。
试回答下列问题:
(1)A的化学式是________。
(2)写出其他几种物质的化学式:B________、C________、D________。
(3)写出实验③中有关反应的离子方程式________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种重要的化工原料,用于电镀、冶金和有机合成医药,农药及金属处理等方面。
已知:氰化钠为白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味,剧毒。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性。
(1)氰化钠中氮元素的化合价是______,用离子方程式表示NaCN溶液呈强碱性的原因:________。
(2)已知:
物质 | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=6.2×10-10 | Ka1=4.5×10-7,Ka2=4.7×10-11, |
则向NaCN溶液通入少量CO2反应的离子方程式:_______________。
(3)用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法错误的是________________。
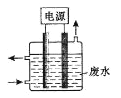
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
C.阴极的电极反应式为:2H2O+2e- =H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+ =N2↑+2CO2↑+5Cl-+H2O
(4)氰化钠可用双氧水进行消毒处理。
用双氧水处理氰化钠产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式____________;
(5)过碳酸钠(2Na2CO3·3H2O2)具有Na2CO3和H2O2的双重性质,也可用于含氰废水的消毒处理。
① 下列物质中,不会引起过碳酸钠发生氧化还原反应的有___________。
A. FeC13 B. CuSO4 C. Na2SiO3 D. KCN
② 已知 6KMnO4 + 5(2Na2CO3·3H2O2)+19H2SO4=3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O.现称取0.2000g 过碳酸钠样品于250mL 锥形瓶中,加50mL蒸溜水溶解,再加50mL 2.0000molL-1H2SO4,用0.0200 molL-1 KMnO4标准溶液滴定至终点时消耗30.00mL,则产品中H2O2的质量分数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com