
【题目】MgCl2和NaHCO3按物质的量之比为1:2混合制成溶液,加热蒸干灼烧后得到的固体是( )
A.Mg(HCO3)2、NaClB.MgO、NaClC.MgCl2、Na2CO3D.MgCO3、NaCl
科目:高中化学 来源: 题型:
【题目】有关实验现象叙述错误的是( )
A.硫蒸汽与H2混合生成H2S
B.NH3使含酚酞的水溶液变红,加热后又恢复到无色
C.NH4Cl固体受热会发生升华
D.浓硝酸久置后颜色会变黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,小烧杯放在一块沾有水的玻璃片上,加入氯化铵固体与氢氧化钡晶体[Ba(OH)28H2O)],并用玻璃棒搅拌,玻璃片上的水结成了冰.由此可知( )
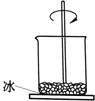
A.该反应中,化学能转变成热能
B.反应物的总能量低于生成物的总能量
C.氯化铵与氢氧化钡的反应为放热反应
D.反应的热化学方程式为 2NH4Cl+Ba(OH)2→BaCl2+2NH3H2O﹣Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+、O2、NO3-等共存物的存在会影响水体修复效果。定义单位时间内ZVI释放电子的物质的量为n1,其中用于有效腐蚀的电子的物质的量为n2。下列说法正确的是
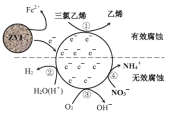
A.反应①在负极发生,②③④均在正极发生
B.单位时间内,三氯乙烯脱去a mol Cl时 n1=amol
C.④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D.增大单位体积水体中小微粒ZVI的投入量,可使n1、n2均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I .光气(COCl2)在塑料、制革、制药等工业上有许多用途。制备光气的方法很多, 下列两种方法常用。
(1)方法一:工业上制备光气的原理:CO+Cl2![]() COCl2,其中原料气CO可利用天然气在氧气中不完全燃烧生产,已知:
COCl2,其中原料气CO可利用天然气在氧气中不完全燃烧生产,已知:
CH4(g)+2O2(g) =CO2(g)+2H2O(1) △H = - 890.3 kJ·mol-1
2CO(g)+O2(g)= 2CO2(g) △H =-566 kJ·mol-1
每生产224LCO (标准状况)所放出的热量约为________ kJ。
(2)方法二:实验室可用氯仿(CHCl3)与双氧水反应制备光气,同时还有一种酸性溶液生成。写出实验室制备光气的化学方程式__________。
II.COCl2 的分解反应为:COCl2(g)![]() Cl2(g)+CO(g) △H =+108 kJ·mol-1 ,反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示(第l0min到14 min的COCl2浓度变化曲线未画出):
Cl2(g)+CO(g) △H =+108 kJ·mol-1 ,反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示(第l0min到14 min的COCl2浓度变化曲线未画出):
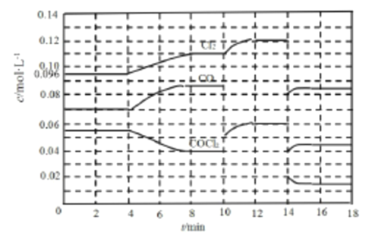
(3)先计算第8 min时CO的浓度,再计算平衡数K=________。
(4)比较第2 min反应温度与第8 min反应温度T8的高低:T2_____T8(选填“ >”、“< ”或“=”)。
(5)若12 min时反应于温度T8下重新达到平衡,则此时c(COCl2)=_____mol·L-1(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A 是农药生产中的一种中间体,结构简式如下图所示。下列叙述中正确的是
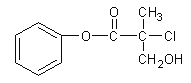
A.1mol A最多能与4mol H2发生加成反应
B.有机物A可以在一定条件下与HBr发生反应
C.有机物A与浓硫酸混合加热,可以发生消去反应
D.1mol A与足量的NaOH溶液反应,最多可以消耗2mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
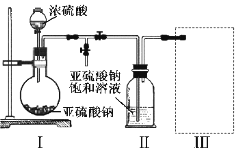
(1)装置I中产生气体的化学方程式为__________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
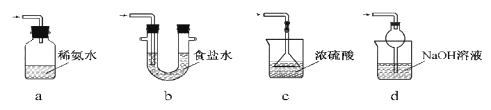
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写正确的是
A.CH4 + Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.CH2=CH2 + Br2![]() CH3CHBr2
CH3CHBr2
C.2CH3CH2OH + O2![]() 2CH3CHO +2H2O
2CH3CHO +2H2O
D.CH3COOH+CH3CH2OH![]() CH3COOHCH2CH3+H2O
CH3COOHCH2CH3+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com