
| A、蒸发操作时,当出现大量晶体是,才能停止加热,用余热加热 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、萃取操作时,应选择有机萃取剂,萃取剂的密度应比水大 |


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
| A、0.92mol |
| B、大于0.46mol 小于0.92mol |
| C、0.46mol |
| D、小于0.46mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、Na+、Cl- |
| B、K+、Na+、NO3-、CO32- |
| C、Na+、H+、NO3-、SO42- |
| D、Al3+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
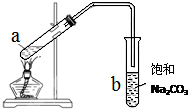 如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )| A、向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 |
| B、试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 |
| C、实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 |
| D、试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8mol/L |
| B、1.2mol/L |
| C、1.6mol/L |
| D、2.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 饱和NaHSO3溶液 |
| 操作1 |
| 乙醚 |
| 萃取操作2 |
| 固体干燥剂 |
| 操作3 |
| 操作4 |
| A、过滤、分液、过滤、蒸馏 |
| B、萃取、过滤、蒸馏、蒸馏 |
| C、过滤、蒸馏、过滤、蒸馏 |
| D、过滤、分液、蒸馏、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
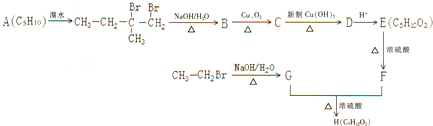
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| D | D元素的单质在C元素的单质燃烧,发出黄色火焰 |
| E | E与C形成的化合物H在大气中形成硫酸型酸雨 |
| F | 与E同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
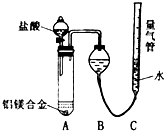 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.| NaOH溶液 |
| 盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com