
| A. |  | B. |  | ||
| C. |  | D. |  |
分析 A、根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同是,能量最低;
B、简并轨道中电子优先单独占据1个轨道,且自旋方向相同,能量最低;
C、2s能级的能量比2p能量低,电子尽可能占据能量最低的轨道;
D、能级能量由低到高的顺序为:1s、2s、2p;每个轨道最多只能容纳两个电子,且自旋相反,简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,能量最低.
解答 解:A、根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同是,能量最低,2p轨道应为: ,故A错误;
,故A错误;
B、简并轨道中电子优先单独占据1个轨道,且自旋方向相同,能量最低,2p轨道应为: ,故B错误;
,故B错误;
C、2s能级的能量比2p能量低,电子尽可能占据能量最低的轨道,所以2s中应容纳2个电子,故C错误;
D、能级能量由低到高的顺序为:1s、2s、2p;每个轨道最多只能容纳两个电子,且自旋相反,简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,能量最低,所以正确的电子排布式为: ,故D正确;
,故D正确;
故选D.
点评 本题考查原子核外电子排布规律,题目难度不大,明确核外电子排布规律为解答关键,注意核外电子排布规律的理解与灵活运用,试题培养了学生的分析能力及灵活应用能力.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子” | |
| B. | 核外电子数为偶数的基态原子,其原子轨道中可能不含“未成对电子” | |
| C. | 核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子” | |
| D. | 核外电子数为奇数的基态原子,其原子轨道中一定不含“未成对电子” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
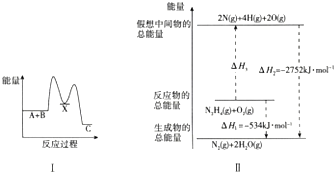
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的分子数目之比为1:1 | B. | 它们的氧原子数目之比为4:5 | ||
| C. | 它们的体积之比为5:4 | D. | 它们所含的硫原子数之比为5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
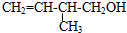
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a${\;}^{-\frac{1}{2}}$ | B. | a${\;}^{\frac{1}{2}}$ | C. | a2 | D. | aˉ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com