
A、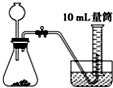 |
B、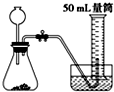 |
C、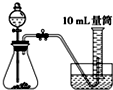 |
D、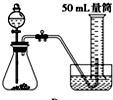 |
| 5mL×1g/mL×3% |
| 34g/mol |
| 1 |
| 2 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
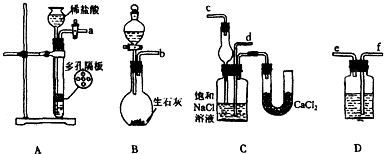
查看答案和解析>>
科目:高中化学 来源: 题型:
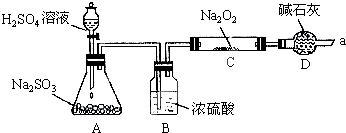
 得出结论:产物是Na2SO4,该方案是否合理
得出结论:产物是Na2SO4,该方案是否合理查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、铁钉镀锌,将锌与电源负极相连,电镀过程需要控制电流强度、溶液pH等条件 |
| C、海轮外壳绑上锌板是采用牺牲阳极的阴极保护法,从而减缓钢铁腐蚀速率 |
| D、电解精炼铜时,阳极溶解铜的总质量和阴极析出铜的总质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
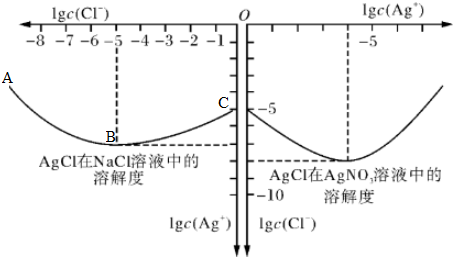
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
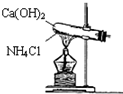 实验室通常用如图所示的装置来制取氨气,(收集装置略).回答下列问题:
实验室通常用如图所示的装置来制取氨气,(收集装置略).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com