
【题目】元素性质呈现周期性变化的根本原因是( )
A. 元素的相对原子质量递增,量变引起质变
B. 元素原子的核外电子排布呈周期性变化
C. 元素的原子半径呈周期性变化
D. 元素的化合价呈周期性变化
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
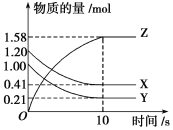
(1)从反应开始到10 s时,用Z表示的反应速率为_____________________________。
(2)该反应的化学方程式为__________________________________________________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 ____________。
2HI(g)达到平衡状态的是 ____________。
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_________。
C(g)+D(g)达到平衡状态的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨的水溶液显弱碱性,其原因为___________________(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,在0.10molL-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)=_______ molL-1;
②某溶液含0.020molL-1Mn2+、0.10molL-1H2S,当溶液pH=_______时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]。
(3)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=___________________;
②0.10molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________;
③H2SO3溶液和NaHCO3溶液反应的离子方程式为___________________;
(4)银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。久存的银器皿表面会变黑,失去银白色的光泽,原因是___________________,已知Ksp(AgCl)=1.8×10-10,若向5mL0.018molL-1的AgNO3溶液中加入5mL0.020molL-1的盐酸,混合后溶液中的Ag+的浓度为_______molL-1,pH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下非金属氧化物与其引起的环境问题及主要来源对应正确的是 ( )
氧化物 | 环境问题 | 主要来源 | |
A | CO2 | 酸雨 | 化石燃料的燃烧 |
B | SO2 | 光化学烟雾 | 汽车尾气的排放 |
C | NO2 | 温室效应 | 工厂废气的排放 |
D | CO | CO中毒 | 燃料的不完全燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验以探究元素性质的递变规律,实验装置如下图所示:

实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,装置C中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为__________________________________。
(2)B装置的作用是____________,C中可观察到的现象是__________________________。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是________________,由此得出碳、硅、氮三种元素非金属性的强弱顺序是________。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。(B装置中装有NaBr溶液,C装置中装有NaOH溶液)
(4)写出B装置中发生反应的离子方程式:___________________________________。
(5)C装置的作用是 。
(6)实验结论:非金属性:Cl______Br(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是

A.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生
B.若A为铁,则足量A与X在室温下即可完全反应
C .X使蔗糖变黑的现象主要体现了X的脱水性
D.工业上,B转化为D的反应条件为高温、常压、使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com